题目内容
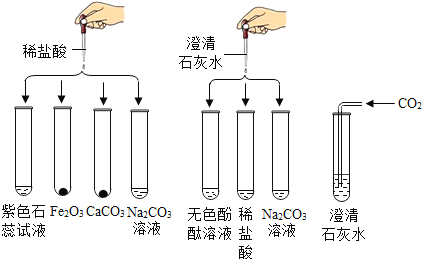
【题目】如下是小符同学在鉴别纯碱溶液和氢氧化钙溶液时所进行的系列实验:
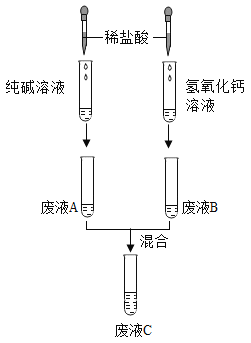
(1)若把废液A逐渐倒入废液B中时,仅产生白色沉淀。则废液A中的溶质是______。
(2)若把废液A逐渐倒入废液B中时,刚开始有气泡冒出,后产生白色沉淀。则废液B中的溶质是______。
(3)若把废液A逐渐倒入废液B中时,无任何明显现象。则废液A中的溶质可能存在______种情况,废液B中的溶质可能存在______种情况。
(4)向废液C中滴入无色酚酞,发现溶液仍为无色。由此推断废液C中的溶质是____(写出所有可能)。
【答案】Na2CO3 、NaCl CaCl2 、HCl 2 3 NaCl 、CaCl2 或NaCl 、CaCl2 、HCl
【解析】
盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,盐酸与氢氧化钙反应生成氯化钙和水。
(1)把A倒入B中只有白色沉淀产生,废液A中含有碳酸钠,因此盐酸无剩余,所以溶质为碳酸钠和生成氯化钠;
故答案为:Na2CO3 、NaCl。
(2)刚开始产生气泡,后有沉淀产生,说明A中碳酸钠剩余,B中有盐酸和氯化钙,刚加入时,碳酸钠与盐酸反应生成二氧化碳,看到了气泡,盐酸反应完毕,碳酸钠与氯化钙反应生成了碳酸钙沉淀,看到了白色沉淀,所以废液B中含有盐酸和氯化钙;
故答案为:CaCl2、HCl。
(3)没有明显现象,说明碳酸钠没有剩余,而盐酸与氢氧化钙反应没有明显现象,所以据此可以分析,A中盐酸与碳酸钠恰好完全反应生成氯化钠、水和二氧化碳,溶质只有氯化钠,此时废液A与废液B混合不发生任何反应,且没有明显现象;A中盐酸过量,溶质为氯化钠和盐酸,此时废液A加入废液B中,盐酸可与氢氧化钙反应,但是也没有明显现象,无法判断,因此A有2中可能,氯化钠或者是盐酸与氯化钠;而B中盐酸与盐酸,氢氧化钙与盐酸都没有明显实验现象,因此,B中可以是盐酸与氢氧化钙恰好反应完毕,只有氯化钙;或者是盐酸过量,溶质为盐酸和氯化钙;又或者是氢氧化钙过量,溶质为氢氧化钙和氯化钙;所以B有3中可能;
故答案为:2;3。
(4)加入酚酞为无色,说明溶液不显碱性,因此不存在碳酸钠或者氢氧化钙,溶液为中性或者酸性,A中反应生成氯化钠,B中反应生成氯化钙,若都恰好完全反应,那此时C中只有氯化钠和氯化钙;若盐酸有剩余,此时为酸性,酚酞加入后也不变色,所以C中为氯化钠、氯化钙和剩余的盐酸;
故答案为:NaCl 、CaCl2 或NaCl 、CaCl2 、HCl。

【题目】甲、乙、丙、丁四种物质间的反应如图所示,“一”表示相连的物质间在一定条件下可以反应,下列选项符合图示反应关系的是
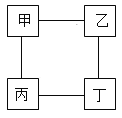
选项 | 甲 | 乙 | 丙 | 丁 |
A | H2 | CuO | O2 | 稀硫酸 |
B | 稀盐酸 | Fe2O3 | Mg | 稀硫酸 |
C | NaOH溶液 | CO2 | CuSO4溶液 | Mg(OH)2 |
D | Fe | CuSO4溶液 | NaOH溶液 | 稀硫酸 |
A.AB.BC.CD.D