题目内容
【题目】人类的生产和生活都离不开金属。


(1)在图(1)所示条件下, 铁钉绣蚀最快的是试管_____(填序号),对比A、B装置,说明铁生锈的条件是_______。
(2)铝的大规模开发和利用比铜和铁晚,这是因为__________。
(3)某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图(2)所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。通过观察,甲同学很快判断锌的活动性比铁强,据你分析,甲同学依据的实验现象是____;他发现铜片表面有银白色固体附着,这说明活动性Cu___Ag(填“>”“<”或“=”),反应的化学方程式是___。
(4)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
实验步骤 | 实验现象 | 实验结论 |
___ | ___ | ___ |
【答案】A 需要氧气参加 铝比铜、铁活泼 锌和稀盐酸反应产生气泡的速率比铁与稀盐酸反应产生气泡的速率快 > Cu+2AgNO3=Cu(NO3)2+2Ag 把铁丝伸入盛有硫酸铜溶液的试管中 铁丝表面附着了一层红色物质,溶液由蓝色变成浅绿色 铁比铜活泼
【解析】
(1)在图(1)所示条件下,因为A中的铁钉与水和氧气充分接触,所以铁钉锈蚀最快;B装置中的铁钉只与水接触,不容易生锈,说明铁生锈需要氧气参加;
(2)铝的大规模开发和利用比铜和铁晚,这是因为铝比铜、铁活泼,铜、铁更容易获得单质;
(3)因为锌和稀盐酸反应产生气泡的速率比铁与稀盐酸反应产生气泡的速率快,所以锌的活动性比铁强;铜片表面有银白色固体附着,说明铜比银活泼;铜和硝酸银反应生成硝酸铜和银,反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)证明铁比铜的活泼的实验:铁能与硫酸铜反应生成硫酸亚铁和铜,能说明铁的活动性强于铜。
实验步骤:把铁丝伸入盛有硫酸铜溶液的试管中;
实验现象:铁丝表面附着了一层红色物质,溶液由蓝色变成浅绿色;
实验结论:铁比铜活泼。

【题目】甲、乙、丙、丁四种物质间的反应如图所示,“一”表示相连的物质间在一定条件下可以反应,下列选项符合图示反应关系的是
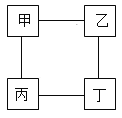
选项 | 甲 | 乙 | 丙 | 丁 |
A | H2 | CuO | O2 | 稀硫酸 |
B | 稀盐酸 | Fe2O3 | Mg | 稀硫酸 |
C | NaOH溶液 | CO2 | CuSO4溶液 | Mg(OH)2 |
D | Fe | CuSO4溶液 | NaOH溶液 | 稀硫酸 |
A.AB.BC.CD.D
【题目】“84”消毒液具有漂白、杀菌、消毒的功效。在新冠肺炎预防措施中使用较为广泛。某化学兴趣小组对一瓶敞口久置的“84”消毒液的成分产生兴趣,在老师的指导下,展开探究。
(査阅资料)“84”消毒液的主要成分是次氯酸钠(NaClO)和氯化钠。NaClO为有效成分,且有腐蚀性并易与空气中的CO2反应(2NaC1O+CO2+H2O=2HC1O+Na2CO3)。NaClO溶液、HC1O都具有漂白、杀菌、消毒功效。HC1O不稳定,受热或光照条件下会发生分解生成氯化氢和氧气。
(分析讨论)小组同学经过讨论,认为该消毒液中的溶质一定有______,可能还有NaClO、Na2CO3、HClO中的一种或多种。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
I.向装入有色布条的试管中加入适量该消毒液 | 有色布条长时间不褪色 | 消毒液中不含的溶质____ |
П.另取少量该消毒液于试管中,滴入足量氯化钡溶液,静置 | 产生白色沉淀 | 消毒液中含有的溶质___ |
(交流反思)
(1)生活中“84”消毒液贮藏时应注意_____。一般不用“84”消毒液对蔬菜、水果进行消毒,其原因可能是_____。
(2)“84”消毒液与洁厕灵(主要成分是盐酸)混合使用易产生一种有毒气体,反应的化学方程式为NaClO+2HC1=NaCl+X↑+H2O,则X的化学式为______。