题目内容
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数.取25g石灰石样品(假设杂质既不溶于水,也不与其它物质反应),向其中加入146g一定溶质质量分数的稀盐酸,恰好完全反应,称得固液混合物的质量为162.2g.请回答下列问题:
(1)写出反应的化学方程式 ;
(2)列出求解该样品中参加反应的碳酸钙质量(x)的比例式 ;
(3)该样品中碳酸钙的质量分数为 ;
(4)向反应后的固液混合物中加入142.8水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为 ;
(5)用36.5%的浓盐酸配制146g上述实验所用的稀盐酸,需要加水的质量为 .
(1)写出反应的化学方程式
(2)列出求解该样品中参加反应的碳酸钙质量(x)的比例式
(3)该样品中碳酸钙的质量分数为
(4)向反应后的固液混合物中加入142.8水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为
(5)用36.5%的浓盐酸配制146g上述实验所用的稀盐酸,需要加水的质量为
考点:根据化学反应方程式的计算,用水稀释改变浓度的方法,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.据此写出化学方程式即可;
(2)根据已知条件和质量守恒定律可知,反应后物质质量之和比反应前物质质量之和减少的质量就是生成气体的质量(因为气体逸出),故生成二氧化碳气体的质量=25g+146g-162.2g=8.8g;然后根据碳酸钙与盐酸反应的化学方程式和二氧化碳的质量,即可得出求解该样品中参加反应的碳酸钙质量(x)的比例式;
(3)由(2)中计算出的该样品中参加反应的碳酸钙质量,根据质量分数公式计算即可;
(4)根据样品中碳酸钙的质量计算出杂质质量,所得不饱和溶液的质量=反应后固液混合物的质量-杂质质量+加入水的质量,溶质质量就是(2)中计算出的溶质(CaCl2)的质量,然后根据溶质质量分数公式计算即可;
(5)根据(2)中计算出的参加反应的HCl的质量计算出实验所用的稀盐酸的质量分数,根据溶质质量一定,利用溶质质量分数公式进行计算即可.
(2)根据已知条件和质量守恒定律可知,反应后物质质量之和比反应前物质质量之和减少的质量就是生成气体的质量(因为气体逸出),故生成二氧化碳气体的质量=25g+146g-162.2g=8.8g;然后根据碳酸钙与盐酸反应的化学方程式和二氧化碳的质量,即可得出求解该样品中参加反应的碳酸钙质量(x)的比例式;
(3)由(2)中计算出的该样品中参加反应的碳酸钙质量,根据质量分数公式计算即可;
(4)根据样品中碳酸钙的质量计算出杂质质量,所得不饱和溶液的质量=反应后固液混合物的质量-杂质质量+加入水的质量,溶质质量就是(2)中计算出的溶质(CaCl2)的质量,然后根据溶质质量分数公式计算即可;
(5)根据(2)中计算出的参加反应的HCl的质量计算出实验所用的稀盐酸的质量分数,根据溶质质量一定,利用溶质质量分数公式进行计算即可.
解答:解:(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)由题意可知,生成二氧化碳气体的质量=25g+146g-162.2g=8.8g;
设该样品中参加反应的碳酸钙质量为x,参加反应的HCl的质量为y,生成氯化钙的质量为z,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
x y z 8.8g
=
,
=
,
=
解之得:x=25g,y=14.6g,z=22.2g;
(3)该样品中碳酸钙的质量分数=
×100%=80%;
(4)石灰石样品中杂质的质量为:25g-20g=5g,
所得不饱和溶液的质量为:162.2g-5g+142.8g=300g,
则所得不饱和溶液中溶质的质量分数为:
×100%=7.4%;
(5)实验所用的稀盐酸的质量分数为:
×100%=10%,
用36.5%的浓盐酸配制146g上述实验所用的稀盐酸,需要加水的质量为:146g-(146g×10%÷36.5%)=106g.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)
=
;(3)80%;(4)7.4%;(5)106g.
(2)由题意可知,生成二氧化碳气体的质量=25g+146g-162.2g=8.8g;
设该样品中参加反应的碳酸钙质量为x,参加反应的HCl的质量为y,生成氯化钙的质量为z,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
x y z 8.8g
| 100 |
| x |
| 44 |
| 8.8g |
| 73 |
| y |
| 44 |
| 8.8g |
| 111 |
| z |
| 44 |
| 8.8g |
解之得:x=25g,y=14.6g,z=22.2g;
(3)该样品中碳酸钙的质量分数=
| 20g |
| 25g |
(4)石灰石样品中杂质的质量为:25g-20g=5g,
所得不饱和溶液的质量为:162.2g-5g+142.8g=300g,
则所得不饱和溶液中溶质的质量分数为:
| 22.2g |
| 300g |
(5)实验所用的稀盐酸的质量分数为:
| 14.6g |
| 146g |
用36.5%的浓盐酸配制146g上述实验所用的稀盐酸,需要加水的质量为:146g-(146g×10%÷36.5%)=106g.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)
| 100 |
| x |
| 44 |
| 8.8g |
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
硫酸钠(Na2SO4)是化学中常见的一种物质,其中硫元素的化合价是( )
| A、+4 | B、6 | C、+6 | D、-2 |
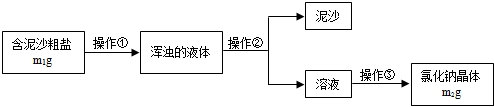
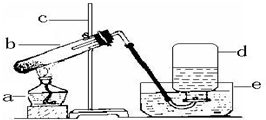 如图为实验室用加热高锰酸钾的方法制取氧气的装置图,回答问题:
如图为实验室用加热高锰酸钾的方法制取氧气的装置图,回答问题:
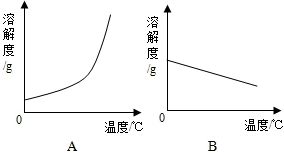 下表是Ca(OH)2 和NaOH的溶解度数据.请回答下列问题:
下表是Ca(OH)2 和NaOH的溶解度数据.请回答下列问题: