题目内容
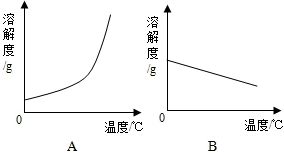 下表是Ca(OH)2 和NaOH的溶解度数据.请回答下列问题:
下表是Ca(OH)2 和NaOH的溶解度数据.请回答下列问题:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度(g) | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,下列具体措施中正确有
①加入氢氧化钙 ②升高温度 ③降低温度 ④加入水 ⑤蒸发水后再恢复到原温度
(3)20℃时,191g饱和NaOH溶液,加热蒸发10g水后,再恢复到20℃,可析出NaOH晶体的质量为
(4)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH固体,应采取的物理方法是
考点:固体溶解度曲线及其作用,饱和溶液和不饱和溶液相互转变的方法,晶体和结晶的概念与现象
专题:溶液、浊液与溶解度
分析:(1)根据物质的溶解度随着温度变化而变化的情况可以判断物质的溶解度曲线;
(2)饱和溶液和不饱和溶液之间可以相互转化;
(3)根据物质的溶解度、饱和溶液的质量可以计算蒸发一定质量的溶剂时析出溶质的质量;
(4)从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶.
(2)饱和溶液和不饱和溶液之间可以相互转化;
(3)根据物质的溶解度、饱和溶液的质量可以计算蒸发一定质量的溶剂时析出溶质的质量;
(4)从溶液中结晶的方法有两种:蒸发结晶和降温结晶,物质的溶解度受温度变化影响较小时,应该用蒸发结晶;物质的溶解度受温度变化影响较大时,应该用降温结晶.
解答:解:(1)由表中数据可知,氢氧化钠的溶解度随着温度的升高而增大,氢氧化钙的溶解度随着温度的升高而减小,如图中能表示NaOH溶解度曲线的是A.
故填:A.
(2)因为氢氧化钙的溶解度随着温度的升高而减小,要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可以采取的方法是:加入氢氧化钙,升高温度,蒸发水后再恢复到原温度.
故填:①②⑤.
(3)20℃时,氢氧化钠的溶解度是91g,设可析出NaOH晶体的质量为x,
100g:91g=10g:x,
x=9.1g,
故填:9.1.
(4)因为氢氧化钠的溶解度受温度影响较大,所以若要得到较纯净的NaOH固体,应采取的物理方法是降温结晶后再过滤.
故填:降温结晶,过滤.
故填:A.
(2)因为氢氧化钙的溶解度随着温度的升高而减小,要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,可以采取的方法是:加入氢氧化钙,升高温度,蒸发水后再恢复到原温度.
故填:①②⑤.
(3)20℃时,氢氧化钠的溶解度是91g,设可析出NaOH晶体的质量为x,
100g:91g=10g:x,
x=9.1g,
故填:9.1.
(4)因为氢氧化钠的溶解度受温度影响较大,所以若要得到较纯净的NaOH固体,应采取的物理方法是降温结晶后再过滤.
故填:降温结晶,过滤.
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
相关题目
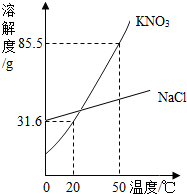 某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.
某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.
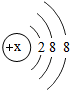 某阴离子结构示意图如图,则x的数值可能是
某阴离子结构示意图如图,则x的数值可能是 (1)用适当的化学符号表示:
(1)用适当的化学符号表示: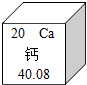 钙元素对人类生命和生活具有重要意义.
钙元素对人类生命和生活具有重要意义.