题目内容
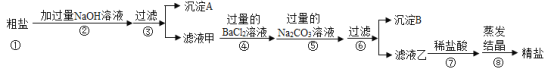
【题目】粗盐中除了含有NaCl外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。同学们为了得到更纯的NaCl,设计了如下实验方案:
请回答下列问题:
(1)沉淀A的化学式是______;
(2)若将步骤④和⑤顺序颠倒会引发的后果是______;
(3)沉淀B中除了含有CaCO3以外还含有______(填化学式);
(4)滤液乙中含有的阴离子是______(填离子符号)。
【答案】Mg(OH)2 精盐中会混有氯化钡 BaSO4 、BaCO3 Cl-、OH-、CO32-
【解析】
(1)盐与碱之间的反应是复分解反应,生成物中必须有沉淀,加入过量NaOH 溶液,NaOH 溶液只能与粗盐中的MgCl2反应,MgCl2 +2NaOH==Mg(OH)2↓+2NaCl,所以沉淀A的化学式是Mg(OH)2。
(2)加入氯化钡,除去SO42-,反应的化学方程式为:Na2SO4+BaCl2==BaSO4↓+2NaCl,加入碳酸钠除去Ca2+和前面过量的Ba2+,反应的化学方程式为:Na2CO3+CaCl2==CaCO3↓+2NaCl、BaCl2 +Na2CO3 ==BaCO3↓+2NaCl。加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的钡离子无法除去,精盐中会混有氯化钡;
(3)根据除杂过程可知,沉淀B中含有CaCO3、BaSO4、BaCO3,故填:BaSO4、BaCO3;
(4)根据除杂过程可知,滤液乙中含有的溶质是NaCl、Na2CO3、NaOH,所以含有的阴离子是Cl-、OH-、CO32-。

【题目】如表是某同学复习整理的部分化学知识,其中完全正确的是
A.化学用语 I2—2个碘原子 He—1个氦气分子 | B.性质用途 石墨能导电,可作电极 稀有气体性质稳定,可制成霓虹灯 |
C.现象描述 磷在空气中燃烧产生大量白雾 硫在空气中燃烧产生淡蓝色火焰 | D.物质分类 焊锡、黄铜、生铁是常见的合金 冰、干冰、双氧水都是氧化物 |
A. A B. B C. C D. D