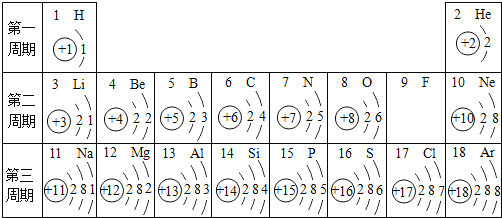
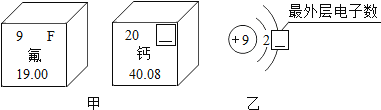
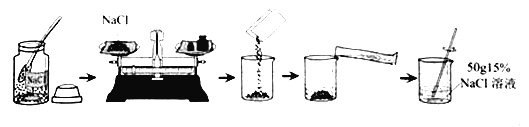
��Ŀ����
����Ŀ��ij��ѧ�С����һ��ʵ���н���������ʾʵ�飺
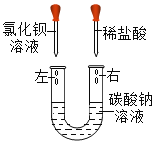
��ʱ�۲쵽U���Ҳ������������___________________________��ʵ���С��ͬѧ�����U�ܣ����ֹ������а�ɫ������������������˺�ͬѧ�Ƕ���Һ�ɷֲ�����Ũ�����Ȥ�����ǽ����˽�һ����̽�����
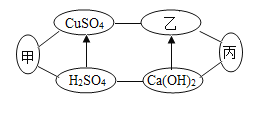
��������⣩����Һ�п��ܺ�����Щ���ʣ�
����������裩������һ������ΪNaCl
�����������ΪNaCl��BaCl2
������������Ϊ______
��ʵ��̽������С��Ϊ��֤��Һ�ijɷ֣�ȡ��Һ���Թ��У������еμ���������������Һ���۲쵽�����������ɴ˵ó����ۣ�����һ������С����ΪС��Ľ��۲����ܣ���Ϊ____________________________��
Ϊ��֤���IJ�������д�±���
ʵ����� | ʵ������ | ʵ����� |
ȡ������Һ�μ�_____ | ��Һ��� | ��������ȷ |
���������ܽᣩ��ͨ������ʵ�������ܹ��ܽ������ȷ����ѧ��Ӧǰ��������Һ�����ʳɷ�ʱ���˿����������⣬��Ҫ����__________________________��
���𰸡��������� NaCl��Na2CO3 ���������ƺ���Һ����������ֻ��˵����Һ��û���Ȼ��������������Ȼ��ƺ�̼���ƵĻ����Һ ��̪��Һ ��Ӧ���Ƿ����
��������
��ͼ��֪���Ҷ�U�ܵμ�ϡ���ᣬϡ������̼������Һ��Ӧ�����ɶ�����̼���壬��ˣ�U���Ҳ�����������Dz������ݣ���Ϊ��U�����˶�û�ܷ⣬��������������ݣ���ֻ���ڷ�Ӧ�ij����Σ������U������Ҹ��������գ�U������ѹǿ��ȣ�Һ����ƽ������д���������ݣ�
��������裺��Ӧ�����U�ܣ����ֹ������а�ɫ���������˵����Һ��һ��û��ϡ���ᣬ��Ӧ��һ�����Ȼ������ɣ����ܲ����������ʣ��������Ȼ���������������̼���ƹ�����̼�������Ȼ������ܹ��棬��ˣ������������ԭ������Ϊ��NaCl��Na2CO3������д��NaCl��Na2CO3��
ʵ��̽�������������ƺ���Һ����������ֻ��˵����Һ��û���Ȼ��������������Ȼ��ƺ�̼���ƵĻ����Һ���ʽ��۲����ܣ�����д�����������ƺ���Һ����������ֻ��˵����Һ��û���Ȼ��������������Ȼ��ƺ�̼���ƵĻ����Һ��
�ɱ���֪����������ȷ���������к���̼���ƣ�̼������Һ�Լ��ԣ���̪��Һ����̼������Һ���죬��ˣ�ʵ������еμӵ��Ƿ�̪��Һ������д����̪��Һ��

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�����Ŀ���Ķ�������ն��ġ�
��ʯ����Ϊ������ͭ�Ļ��ķ���ء���ͭ�ųơ����𡱣���Ϊ���ɫ����Ҫ��ͭ������Ǧ�ĺϽ�����ͭ�������ɫ�� ������ͭ�������ִ�����������ͭ��������ʴ�ɷֿ��������Ƕ���ͭ����������о��ͱ�����
�о���Ա����X���������Ƕ��ҹ���������ijĹ�س�������ͭ�����������������ijɷֽ����˷����������������ķֲ�Ƶ����ͼ��
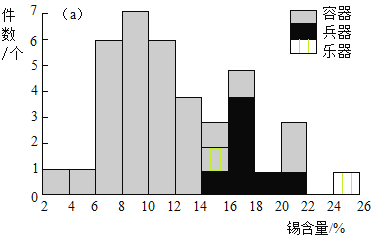
�о���Ա����X����������������ԡ����֮������ĸ�춦�����㲿λ����ʴ��Ʒ���з�����������£�
��ʴ�ɷ� ��Ʒ��� | Cu2Cl(OH)3 | Cu2O | Cu2CO3(OH)2 | SnO2 | ���� |
1 | 98% | 2% | 0 | 0 | 0 |
2 | 5% | 95% | 0 | 0 | 0 |
3 | 29% | 34% | 12% | 0 | 25% |
4 | 61% | 0 | 4% | 9% | 26% |
�����ɷ��У���ʽ�Ȼ�ͭ[Cu2Cl(OH)3]����ͭ�����Σ����������һ��մȾ���������ʣ��ڻ���ʪ�����˵������£��ͻ���������һ����Ⱦ�����ӣ�����������á����ף�ֱ�������߽⡣
�����������ݻش��������⡣
��1����ͭ������_________��
A �������ϡ� B �ϳɲ���
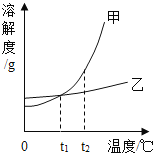
��2�����������ķֲ�Ƶ��ͼ�ƶϣ�ij����ͭ������������������_____
A 4% B 18%
��3����ĸ�춦�������ϵ���ʴ�ɷ��У�Cu2O����__________��
A ����� B ��
��4����ʽ�Ȼ�ͭ[Cu2Cl(OH)3]�������뻷���е�������ˮ��_________������ء�
A �Ȼ��� B ������̼
��5������Ա���������ͭ�����һ������������____________��