题目内容
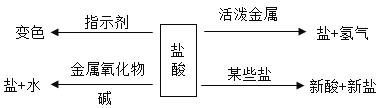
【题目】老师要求用规定的BaCl2溶液与适量的Na2SO4溶液制备BaSO4。完成操作Ⅰ后,小红发现自己错把Na2CO3溶液当成Na2SO4溶液,而此时BaCl2溶液已完全消耗。老师启发他,可用生成物和其他试剂完成制备BaSO4的实验。整个实验流程如图所示:

(1)试剂M是__________,气体C是__________。
(2)操作Ⅱ的名称是_________。
(3)反应①的化学方程式为________,溶液a中溶质是_______。
(4)反应③的基本反应类型为___________。
(5)从理论上讲,该实验过程最终得到的BaSO4质量与原方案得到的BaSO4质量是否相等?_________(填“是”或“否”)。
【答案】盐酸 CO2 蒸发结晶 BaCl2+ Na2CO3=2NaCl+BaCO3↓ NaCl 复分解反应 是
【解析】
反应①BaCl2 + Na2CO3= BaCO3↓+2NaCl固体B为BaCO3, 溶液a为NaCl溶液,由最后的反应物为BaSO4,可推测需要先加酸溶解BaCO3,滤液再和Na2SO4生成BaSO4沉淀,因此M试剂为盐酸,N为Na2SO4,选用HCl溶解BaCO3, 会生成CO2气体,故C为CO2,因为HCl过量,因此溶液b中溶质含有BaCl2和HC1;
(1)分析得:M为盐酸气体C是二氧化碳,故填:盐酸;CO2。
(2)氯化钠溶液蒸发结晶得到氯化钠,故填:蒸发结晶。
(3)由分析可得反应①化学方程式为BaCl2 + Na2CO3= BaCO3↓+2NaCl,固体B为BaCO3, 溶液a为NaCl溶液,故填:BaCl2 + Na2CO3= BaCO3↓+2NaCl;NaCl。
(4)反应③硫酸钠和氯化钡反应生成氯化钠和硫酸钡沉淀,两种化合物交换成分生成另外两种化合物,属于复分解反应,故填:复分解反应。
(5)根据质量守恒定律,BaCl2转化为 BaSO4中Ba原子守恒,可以判断实验过程最终得到的BaSO4质量与原方案得到的BaSO4质量相等,故填:是。

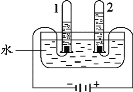
【题目】某化学活动小组在一次实验中进行如下所示实验:
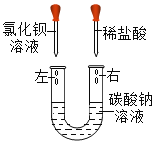
此时观察到U型管右侧产生的现象是___________________________,实验后,小组同学充分振荡U型管,发现管内仍有白色固体残留,将混合物过滤后,同学们对滤液成分产生了浓厚的兴趣,于是进行了进一步的探究活动。
(提出问题):滤液中可能含有哪些物质?
(猜想与假设):猜想一:溶质为NaCl
猜想二:溶质为NaCl和BaCl2
猜想三:溶质为______
(实验探究):小红为验证滤液的成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立。小刚认为小红的结论不严密,因为____________________________。
为验证三的猜想请填写下表:
实验过程 | 实验现象 | 实验结论 |
取少量滤液滴加_____ | 溶液变红 | 猜想三正确 |
(归纳与总结):通过上述实验我们能够总结出:在确定化学反应前后所得溶液中溶质成分时除了考虑生成物外,还要考虑__________________________。
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A | B |
(1)电解水实验揭示了水的组成。下图实验中得到氧气的试管是_______(填“1”或“2”)。 (2)电解水的化学方程式为_________。
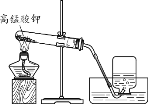
| (1)潜水时需要氧气,说明氧气能________。 (2)用高锰酸钾制取氧气的化学方程式为_________。
|
【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1