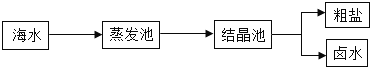
题目内容
【题目】室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化的曲线如图所示
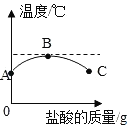
(1)如图所示,稀盐酸与氢氧化钠溶液发生的中和反应是_____(填“吸热”或“放热”或“无热量变化”)反应。
(2)在B处溶液中加入石蕊溶液,溶液呈_____色。
(3)C处溶液的溶质是_____(填化学式)。
(4)B到C的过程中溶液的pH逐渐_____(填“增大”或“减小”或“无变化”)。
(5)在C点溶液中加入碳酸钙,现象为_____。
【答案】放热 紫 NaCl和HCl 减小 固体溶解,且产生气泡
【解析】
(1)如图所示,稀盐酸与氢氧化钠溶液发生的中和反应是放热反应。
(2)在B处,溶液的温度最高,稀盐酸与氢氧化钠恰好完全反应,此时溶液呈中性,溶液中加入石蕊溶液,溶液呈紫色。
(3)稀盐酸与氢氧化钠反应:NaOH+HCl=NaCl+H2O,继续滴加稀盐酸,则C处溶液的溶质是NaCl和HCl。
(4)B到C的过程中,继续滴加稀盐酸,溶液由中性变为酸性,溶液的pH逐渐减小。
(5)在C点溶液中加入碳酸钙,碳酸钙与稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑现象为:固体溶解,且产生气泡

【题目】氨气(NH3)的合成是人类科学技术上的重大突破。合成氨工艺的主要流程如下:
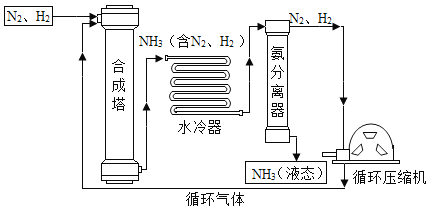
(1)合成塔中的反应必须在高温、高压并使用催化剂的条件下进行。该反应的化学方程式为____________。
(2)生产过程中可循环使用的物质是__________。
(3)将沸点不同的气体分离开来,常采用液化分离法。如:控制温度在-195.8℃ 至-183℃之间时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2 分离开来,最适宜的温度应该控制在___________之间。
物质 | H2 | N2 | O2 | NH3 |
沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
【题目】有关物质组成及化学规律的发现对化学的发展做出了重要贡献。
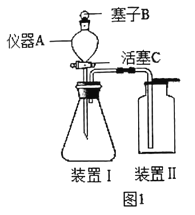
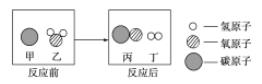
(你知道吗)二百多年前,法国化学家拉瓦锡用定量的方法研究空气成分,其中一项实验是加热红色氧化汞粉末得到汞和氧气(图 1),该反应的微观示意图如图:
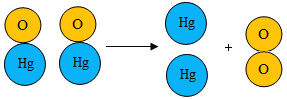
下列说法正确的是_____(多选,填字母)
A 该反应为化合反应
B 1个氧分子是由 2 个氧原子构成的
C 氧化汞分解过程中,原子的个数没有发生改变
D 氧化汞分解过程中,分子的种类没有发生改变
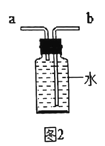
(实验回顾)实验室常用图 2所示的方法测定空气中氧气的含量。写出红磷燃烧的文字表达式_____,实验中加入足量红磷的目的是_____。
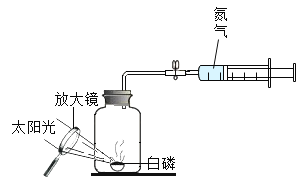
(实验探究)同学们发现利用图 2装置进行实验时,在集气瓶外点燃红磷,一方面会造成空气污染,另一方面伸进集气瓶速度慢了会影响测定结果。他们查阅资料发现白磷40°即可燃烧,燃烧产物与红磷相同。于是改进装置(图 3)重新探究。先在容积为 200mL的集气瓶里装进 50mL的水,再在量筒内装入 100mL的水,然后按图3连好仪器,按下热的玻璃棒,白磷立即被点燃。
(1)集气瓶里预先装进的水,在实验过程中除了能够吸收白烟作用。还起到_____、_____作用。
(2)如果白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定的空气中氧气含量结果_____(填“偏大”、“偏小”或“不变”)。
(定量研究)某校化学兴趣小组的同学设计了如图4所示的装置进行空气中氧气含量实验的探究:实验前注射器中有20mL氮气,100mL集气瓶中加入10mL水。实验数据记录如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/mL | 20.0 | 34.0 | 40.0 | 30.0 | 25.6 | 18.0 | 12.5 | 8.6 | 4.8 | 2.0 | 2.0 |
(1)根据以上实验过程和数据综合分析,集气瓶内空气中氧气的体积是_____mL;开始体积增大的原因是_____。
(2)根据题中数据计算测得的空气中氧气的体积分数_____。
(交流反思)小明同学提出了能否用铁丝燃烧代替上述实验中的白磷,同学们一致反对,理由是_____,写出铁丝在氧气中燃烧的文字表达式_____。
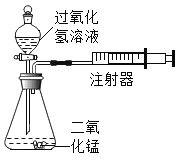
【题目】化学实验小组设计如图装置:通过测定产生相同体积气体所用时间长短来探究影响双氧水分解速率的因素。
(1)实验小组有如下设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 所需时间 |
实验I | 探究________ 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL2%H2O2 | 60秒 |
实验II | 25℃ | 二氧化锰 | 10mL12%H2O2 | 30秒 |
由上表数据可知:双氧水的浓度越大,其分解速率________
(2)催化剂在生产、生活和科研中的地位越来越重要。实验室用过氧化氢溶液分解制取氧气时,就常用二氧化锰作催化剂。
[提出问题]氧化铜(CuO)能否起到类似MnO2的催化剂作用呢?
[猜想假设]猜想一: CuO不是该反应的催化剂。
猜想二: CuO参与反应产生O2,反应前后质量和化学性质发生了改变。
猜想三: CuO是反应的催化剂,反应前后_______
[实验探究]用天平称量0.2gCu0,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(注:氧化铜不落于水。过滤可与水分离)
[交流讨论]
(1)填写下表
步驟③现象 | 步驟⑤结果 | 结论 |
产生大量的气泡,带火星的木条发燃。 | 得到氧化铜的质量为__g | 猜想一、二不成立:猜想三成立。 |
(2)步骤④需用到的玻璃仪器有:玻璃棒、烧杯和________其中玻璃棒的作用________