题目内容
【题目】有关物质组成及化学规律的发现对化学的发展做出了重要贡献。
(你知道吗)二百多年前,法国化学家拉瓦锡用定量的方法研究空气成分,其中一项实验是加热红色氧化汞粉末得到汞和氧气(图 1),该反应的微观示意图如图:
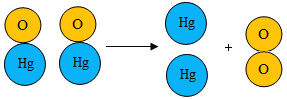
下列说法正确的是_____(多选,填字母)
A 该反应为化合反应
B 1个氧分子是由 2 个氧原子构成的
C 氧化汞分解过程中,原子的个数没有发生改变
D 氧化汞分解过程中,分子的种类没有发生改变
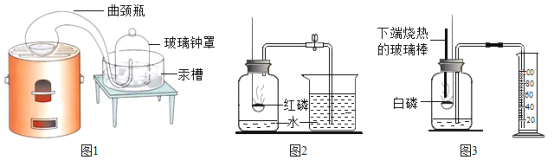
(实验回顾)实验室常用图 2所示的方法测定空气中氧气的含量。写出红磷燃烧的文字表达式_____,实验中加入足量红磷的目的是_____。
(实验探究)同学们发现利用图 2装置进行实验时,在集气瓶外点燃红磷,一方面会造成空气污染,另一方面伸进集气瓶速度慢了会影响测定结果。他们查阅资料发现白磷40°即可燃烧,燃烧产物与红磷相同。于是改进装置(图 3)重新探究。先在容积为 200mL的集气瓶里装进 50mL的水,再在量筒内装入 100mL的水,然后按图3连好仪器,按下热的玻璃棒,白磷立即被点燃。
(1)集气瓶里预先装进的水,在实验过程中除了能够吸收白烟作用。还起到_____、_____作用。
(2)如果白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定的空气中氧气含量结果_____(填“偏大”、“偏小”或“不变”)。
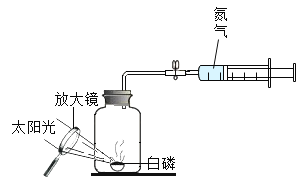
(定量研究)某校化学兴趣小组的同学设计了如图4所示的装置进行空气中氧气含量实验的探究:实验前注射器中有20mL氮气,100mL集气瓶中加入10mL水。实验数据记录如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/mL | 20.0 | 34.0 | 40.0 | 30.0 | 25.6 | 18.0 | 12.5 | 8.6 | 4.8 | 2.0 | 2.0 |
(1)根据以上实验过程和数据综合分析,集气瓶内空气中氧气的体积是_____mL;开始体积增大的原因是_____。
(2)根据题中数据计算测得的空气中氧气的体积分数_____。
(交流反思)小明同学提出了能否用铁丝燃烧代替上述实验中的白磷,同学们一致反对,理由是_____,写出铁丝在氧气中燃烧的文字表达式_____。
【答案】BC 磷+氧气![]() 五氧化二磷 使氧气完全反应 液封导管 缓冲瓶内压强 偏小 18 红磷燃烧放热,使瓶内压强变大 20% 铁丝在空气中不能燃烧 铁+氧气
五氧化二磷 使氧气完全反应 液封导管 缓冲瓶内压强 偏小 18 红磷燃烧放热,使瓶内压强变大 20% 铁丝在空气中不能燃烧 铁+氧气![]() 四氧化三铁
四氧化三铁
【解析】
[你知道吗]
A.该反应为分解反应,该选项说法不正确;
B.1 个氧分子是由 2 个氧原子构成的,该选项说法正确;
C.氧化汞分解过程中,原子的个数没有发生改变,该选项说法正确;
D.氧化汞分解过程中,分子的种类发生改变,该选项说法不正确。
故填:BC。
[实验回顾]
红磷燃烧生成五氧化二磷,反应的文字表达式:磷+氧气![]() 五氧化二磷,实验中加入足量红磷的目的是使氧气完全反应。
五氧化二磷,实验中加入足量红磷的目的是使氧气完全反应。
故填:磷+氧气![]() 五氧化二磷;使氧气完全反应。
五氧化二磷;使氧气完全反应。
[实验探究]
(1)集气瓶里预先装进的水,在实验过程中除了能够吸收白烟作用。还起到液封导管、缓冲瓶内压强作用。
故填:液封导管;缓冲瓶内压强。
(2)如果白磷停止燃烧时立即记录量筒内剩余水的体积,会导致进入集气瓶中的水的体积偏小,则会导致测定的空气中氧气含量偏小。
故填:偏小。
[定量研究]
(1)根据以上实验过程和数据综合分析,集气瓶内空气中氧气的体积是20mL﹣2mL=18mL;
开始体积增大的原因:白磷燃烧放热,使瓶内压强变大。
故填:18;白磷燃烧放热,使瓶内压强变大。
(2)测得的空气中氧气的体积分数:![]() ×100%=20%,
×100%=20%,
故填:20%。
[交流反思]
同学们一致反对,理由是铁丝在空气中不能燃烧;
铁丝在氧气中燃烧生成四氧化三铁,反应的文字表达式:铁+氧气![]() 四氧化三铁。
四氧化三铁。
故填:铁丝在空气中不能燃烧;铁+氧气![]() 四氧化三铁。
四氧化三铁。

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案