题目内容
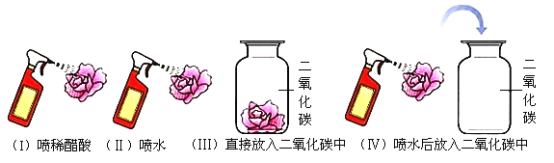
【题目】初中实验室有一瓶标签破损的溶液(如图),为确定其成分,某组同学进行了如下探究活动:

(1)同学们提出以下猜想:
A同学: HCl
B同学: H2O2
C同学: H2SO4
从受损标签的信息来看________________________的猜想肯定错误;
(2) B同学为验证其猜想,在试管中加入了一种黑色粉末________ (填化学式),并在试管口放一根带火星的小木条,但他未观察到任何明显的现象,由此,同学们确定C同学猜想正确;
(3)老师要求同学们用多种方案来验证该结论,请你参与设计。
方案 | 实验操作 | 实验现象及化学方程式 |
方案1 | 试管中加入少量Na2CO3粉末后再加入过量的该溶液 | 溶液中有________________________产生 |
方案2 | 试管中加少量CuO后再加入过量的该溶液 | 现象:________________________。 化学方程式:________________________。 |
方案3 | 试管中加入少量____________________(填“Zn” 或“Cu”)后再加入少量的该溶液 | 固体表面有气泡产生 |
方案4 | 取样后加入过量__________________________溶液,振荡,再加入过量稀硝酸 | 有白色沉淀产生,加入硝酸后白色沉淀无变化 |
【答案】A同学 MnO2 气泡 黑色固体逐渐溶解,溶液由无色变为蓝色 ![]() Zn BaCl2[或Ba( NO3)2]
Zn BaCl2[或Ba( NO3)2]
【解析】
(1)从标签信息中H的角码为“2”可以得出A同学的猜想错误;
(2)H2O2 在MnO2的催化作用下可以产生O2,故黑色粉末为二氧化锰,化学式为:MnO2,但实验现象为带火星的小木条无明显变化,说明无氧气产生,故B同学的猜想错误;
(3)若要证明该溶液是H2SO4,可验证H+或SO42-是否存在,
方案1是加入少量Na2CO3粉末,碳酸钠可与稀硫酸反应生成硫酸钠、二氧化碳和水,故若有气泡产生,则证明有氢离子存在,故实验现象为溶液中有气泡产生;
方案2是加入少量CuO固体,氧化铜能和稀硫酸反应生成硫酸铜和水,若黑色固体逐渐消失,溶液由无色变为蓝色,证明有氢离子存在,故实验现象为黑色固体逐渐消失,溶液由无色变为蓝色,该反应的化学方程式为:![]() ;
;
方案3实验现象是固体表面有气泡产生,则加入的是金属Zn,因为铜不与稀硫酸反应;
方案4是检验硫酸根离子的存在,实验现象是有白色沉淀产生,加入硝酸后白色沉淀无变化,故加入的是BaCl2或Ba( NO3)2溶液,因为氯化钡(或硝酸钡)可与稀硫酸反应生成硫酸钡沉淀。

【题目】阅读下面科普短文。
“菠菜豆腐”是我国的传统菜肴,近年来,有关“菠菜豆腐”的争论主要集中在钙吸收率方面。菠菜中富含易溶于水的草酸,若单独吃菠菜,其中的草酸会结合胃内食糜中的部分铁和锌,还能够进入血液,沉淀血液中所含的钙。而将豆腐与菠菜同食,豆腐中的可溶性钙与菠菜中的草酸结合成不溶性的草酸钙(CaC2O4)沉淀,既能够保护食物中的铁和锌等元素,还能保证人体内的钙不被草酸结合。因此,豆腐与菠菜同食仍不失为一个好的搭配。
研究人员以新鲜菠菜和新鲜豆腐为材料,进行了“菠菜豆腐”烹调方法的研究。
(实验1)探究菠菜质量对菜肴中可溶性钙含量的影响。实验结果如下:
豆腐/ g | 10 | 10 | 10 | 10 | 10 |
菠菜/ g | 5 | 10 | 15 | 20 | 25 |
可溶性钙/总钙 | 0.364 | 0.287 | 0.186 | 0.125 | 0.088 |
(实验2)探究菠菜焯水时间对菜肴中可溶性钙含量的影响。
用100g豆腐和250g菠菜(焯水时间不同)制成菜肴,测定每100g“菠菜豆腐”中可溶性钙的质量,结果见下图。

以上研究表明,烹调“菠菜豆腐”时,如能适当减少菠菜的比例,并预先将菠菜焯水,则豆腐中钙的吸收率将会显著提高。
根据文章内容,回答下列问题:
(1)可溶性钙中的“钙”是指_________(“钙单质”或“钙元素”)。
(2)豆腐中富含的营养素是_____________。
A. 维生素 B. 糖类 C. 蛋白质 D. 油脂
(3)结合实验1的数据分析,可得到的结论是_________________。
(4)用焯水后的菠菜制作“菠菜豆腐”,能提高可溶性钙含量的原因是__________。
(5)草酸钙在高温下完全分解可得到两种气态氧化物和一种固态氧化物,该反应的化学方程式为____________________。