题目内容
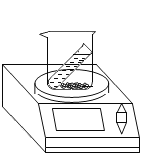
【题目】用如图所示的装置进行实验,验证质量守恒定律。
| 实验1 | 实验2 | ||
实验药品 | 硫酸铜溶液、铁 | 过氧化氢溶液、二氧化锰 | ||
电子秤示数 | 反应前 | m1 | m3 | |
反应后 | m2 | m4 | ||
(1)实验2发生反应的化学方程式为____________________________。
(2)实验2中药品混合后,烧杯内可观察到的现象为___________________。
(3)比较反应前后电子秤示数,描述正确的是__________(填序号)。
Am1=m2 Bm1<m2 Cm3= m4 Dm3> m4
【答案】2H2O2![]() 2H2O +O2↑ 产生大量气泡 AD
2H2O +O2↑ 产生大量气泡 AD
【解析】
(1)实验2发生的反应是过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O +O2↑;
2H2O +O2↑;
(2)实验2中药品混合后,烧杯内可观察到的现象为产生大量气泡。
(3)铁与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式式是Fe+CuSO4==Cu+FeSO4,反应中没有气体的逸出,也没有吸收空气中的气体,比较反应前后电子秤的示数,m1=m2;过氧化氢在二氧化锰催化作用下分解生成水和氧气,产生的氧气逸出,烧杯内的物质质量减小,比较反应前后电子秤的示数,m3>m4。故选AD。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
【题目】在一定条件下,向一密闭的容器内加入A、B、C、D四种物质各20g,充分反应后,测定其质量,得到数据如下:
物质 | A | B | C | D |
反应前质量/g | 20 | 20 | 20 | 20 |
反应后质量/g | 20 | 30 | 未知 | 14 |
(1)反应后C的质量是_____g。
(2)A物质可能是_____(填“反应物”或“生成物”“催化剂”)。
(3)容器中B物质肯定是_____填“单质”或“化合物”)。
(4)容器中发生反应的基本反应类型是_____。