题目内容
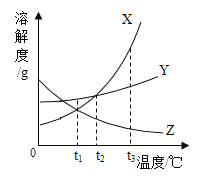
【题目】下表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
①硝酸钾和氯化钠的溶解度相同时的温度范围是_______;
A 0°C-20°C B 20°C-40°C C 40°C-60°C D 60°C-80°C
②20°C时,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是_______;要进一步提高该溶液的溶质质量分数,可进行的操作是_______。
③在80°C的100g水中溶解NaCl和KNO3,进行以下实验,己知溶液a中的硝酸钾恰好饱和:
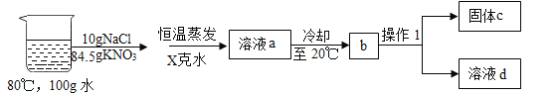
Ⅰ. 操作1的名称是______;
Ⅱ. X=_______克,固体C的成分和该成分的质量分别是______和________;
Ⅲ. 对整个实验过程分析正确的是________;
A 40°C-60°C开始析出晶体
B 氯化钠在整个过程中一直保持不饱和状态
C 上述方法不能将氯化钠和硝酸钾完全分离
D 原溶液直接降温结晶,析出硝酸钾的质量不变
【答案】B 65.8g 升高温度 过滤 50 硝酸钾 68.7g BC
【解析】
①由表中数据可知,硝酸钾和氯化钠的溶解度相同时的温度范围是20°C-40°C,故选B。②20°C时,KNO3的溶解度为31.6g,则50g水中最多能溶解15.8gKNO3,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是15.8g+50g=65.8g。由于KNO3的溶解度随温度的升高而增大,故要进一步提高该溶液的溶质质量分数,可进行的操作是升高温度。
③Ⅰ.通过过滤可将难溶于水的固体物质与液体分离,故操作1的名称是过滤;
Ⅱ.80°C时,硝酸钾的溶解度是169.0g,溶液a中溶有84.5g硝酸钾恰好饱和,说明此时水的质量为50g,X=100g-50g=50g。根据硝酸钾的溶解度可知,20°C时,50g水中最多能溶解硝酸钾的质量为15.8g,则固体C中硝酸钾的质量为84.5g-15.8g=68.7g。氯化钠的溶解度受温度影响较小,从80°C降温至20°C过程中没有析出,所以固体C是68.7g的硝酸钾;
Ⅲ. A 硝酸钾的溶解度随温度的升高而增大,溶液a中的硝酸钾恰好饱和,温度小于80°C,硝酸钾就有晶体析出,此选项错误;
B 氯化钠的溶解度受温度影响较小,在整个过程中一直保持不饱和状态,此选项正确;
C 硝酸钾总会溶解,氯化钠的溶解度受温度影响较小,上述方法不能将氯化钠和硝酸钾完全分离,此选项正确;
D 原溶液中溶剂质量为100g,a溶液中溶剂质量为50g,故原溶液直接降温结晶,析出硝酸钾的质量减少,此选项错误。故选BC。

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组的同学欲测定一份铜和锌混合物中锌的质量分数(铜和稀硫酸不反应),进行了如下实验。称量一定量铜和锌混合物放入烧杯中再加入100克质量分数为10%的稀硫酸,在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设匀速进行,烧杯质量25g)
反应时间(m) | 2 | 4 | 6 | 8 | 10 |
烧杯和剩余物的质量(g) | 134.97 | m | 134.91 | 134.90 | 134.90 |
请计算:
(1)表中“m”为_____g;
(2)该锌混合物中锌的质量分数?_____(写过程)