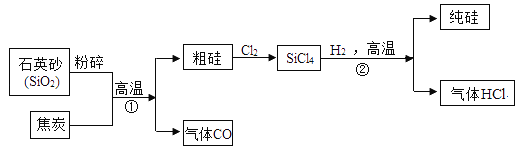
题目内容
【题目】兴趣小组的同学对铜及其化合物进行了相关探究。
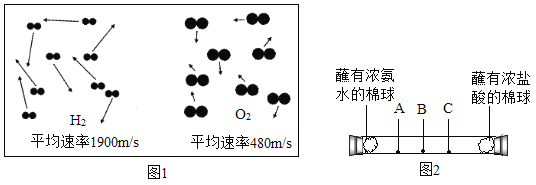
(实验回顾)用如图 1 所示装置,利用铁生锈的原理可以比较准确地测出空气中氧气的含量。
(提出问题)若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气 中氧气的含量?
(查阅资料)铜能与空气中氧气、水、二氧化碳反应生成铜绿,化学方程式:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
(交流与讨论)若将图2 装置中的细铁丝换成足量的细铜丝进行实验,________(填“能” 或“不能”)比较准确地测出空气中氧气的含量,理由是________。
(拓展探究)工业上可用废铜屑、空气与稀硫酸在 80℃条件下制备硫酸铜。
①如图 3是实验室拟工业制备硫酸铜的装置,采用水浴加热的优点是________, 多孔球泡的作用为________。
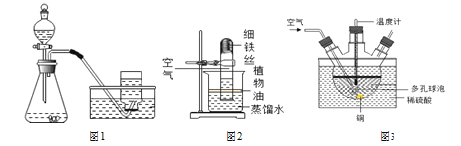
②工业生产时可用纯氧代替空气。这一措施能加快反应速率外,还具有的优点是________。
③用如图 1所示装置制备氧气,反应的化学方程式为________, 收集一瓶氧气的方法是:当气泡连续均匀冒出时,把导管伸入盛满水的集气瓶中,氧气充满 集气瓶后,________,把集气瓶拿出水槽,正放于实验桌。
(定量分析)称取 14.4g 仅含 Cu、O 两种元素的固体样品,采用如图 4 所示装置实验(夹 持装置省略)。完全反应后,测得实验前后装置 B 增重 4.4g。
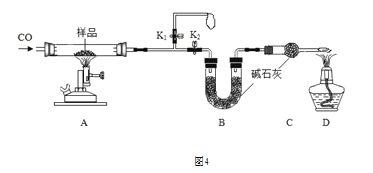
①实验开始前应先关闭________,打开________。
②装置 B 的作用是________。
③铜元素有多种氧化物,如 CuO、Cu2O。根据实验数据进行计算,该固体样品成分可能是______(填序号)。
A.Cu2O B.Cu、CuO C.CuO、Cu2O D.Cu、CuO、Cu2O
【答案】不能 空气中二氧化碳的含量极低,与氧气的含量差距太大,不能将氧气消耗完全 控制反应物的温度,使其均匀受热 增大气体与溶液的接触面积,是反应充分进行 排除空气中气体气体的干扰 2H2O2![]() 2H2O+O2↑ 用毛玻璃片盖住集气瓶口 k2 k1 吸收装置A中产生的二氧化碳气体 ABD
2H2O+O2↑ 用毛玻璃片盖住集气瓶口 k2 k1 吸收装置A中产生的二氧化碳气体 ABD
【解析】
交流与讨论:若将图 2 装置中的细铁丝换成足量的细铜丝进行实验,不能比较准确地测出空气中氧气的含量,理由是:空气中二氧化碳的含量极低,与氧气的含量差距太大,不能将氧气消耗完全;
拓展探究:①实验室拟工业制备硫酸铜的装置,采用水浴加热的优点是:控制反应物的温度,使其均匀受热; 多孔球泡的作用为:增大气体与溶液的接触面积,是反应充分进行;
②工业生产时可用纯氧代替空气。这一措施能加快反应速率外,还具有的优点是:排出空气中气体气体的干扰;
③用如图 1 所示装置制备氧气,反应不需要酒精灯加热,过氧化氢在二氧化锰催化作用下产生水和氧气的化学方程式为:2H2O2![]() 2H2O+O2↑, 收集一瓶氧气的方法是:当气泡连续均匀冒出时,把导管伸入盛满水的集气瓶中,氧气充满 集气瓶后,用毛玻璃片盖住集气瓶口,把集气瓶拿出水槽,正放于实验桌。
2H2O+O2↑, 收集一瓶氧气的方法是:当气泡连续均匀冒出时,把导管伸入盛满水的集气瓶中,氧气充满 集气瓶后,用毛玻璃片盖住集气瓶口,把集气瓶拿出水槽,正放于实验桌。
定量①实验开始前应先关闭k2,打开k1,因为一氧化碳具有可燃性,先将装置中的空气排除干净,防止加热后,通入一氧化碳发生爆炸;
②装置 B 的作用是:吸收装置A中产生的二氧化碳气体;
③实验前后装置 B 增重 4.4g为二氧化碳质量;
4.4g二氧化碳中碳元素质量为4.4g×![]() ,由碳元素守恒可知,一氧化碳中碳元素质量为1.2g,则一氧化碳的质量为1.2g
,由碳元素守恒可知,一氧化碳中碳元素质量为1.2g,则一氧化碳的质量为1.2g![]() ;
;
则14.4g 仅含 Cu、O 两种元素的固体样品中氧元素质量为4.4g-2.8g=1.6g;铜元素质量为14.4g-1.6g=12.8g,铜原子与氧原子个数比=![]() ,
,
A.Cu2O中铜原子与氧原子个数比为2:1;故选项正确;
B.Cu、CuO 混合可以配成铜原子与氧原子个数比为2:1 ;故选项正确;
C.CuO中铜原子与氧原子个数比为1:1与Cu2O中 铜原子与氧原子个数比为2:1混合后,铜原子与氧原子个数比一定不是2:1;故选项错误;
D.Cu、CuO、Cu2O混合可以配成铜原子与氧原子个数比为2:1 ;故选项正确;
故选:ABD。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
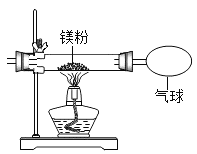
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(作出猜想)黄色固体是Mg3N2。
(实验探究)设计实验,验证猜想:
实验操作 | 实验现象及结论 |
__________ | ___________ |
(反思与交流)①空气中N2的含量远大于O2的含量,可是镁条在空气中的燃烧产物MgO却远多于Mg3N2,合理的解释是________。
②同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识________。
【题目】下表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
①硝酸钾和氯化钠的溶解度相同时的温度范围是_______;
A 0°C-20°C B 20°C-40°C C 40°C-60°C D 60°C-80°C
②20°C时,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是_______;要进一步提高该溶液的溶质质量分数,可进行的操作是_______。
③在80°C的100g水中溶解NaCl和KNO3,进行以下实验,己知溶液a中的硝酸钾恰好饱和:
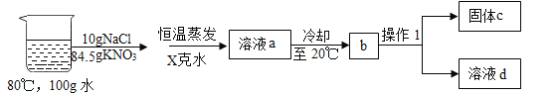
Ⅰ. 操作1的名称是______;
Ⅱ. X=_______克,固体C的成分和该成分的质量分别是______和________;
Ⅲ. 对整个实验过程分析正确的是________;
A 40°C-60°C开始析出晶体
B 氯化钠在整个过程中一直保持不饱和状态
C 上述方法不能将氯化钠和硝酸钾完全分离
D 原溶液直接降温结晶,析出硝酸钾的质量不变