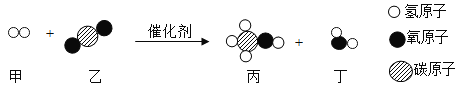
题目内容
【题目】某化学兴趣小组的同学欲测定一份铜和锌混合物中锌的质量分数(铜和稀硫酸不反应),进行了如下实验。称量一定量铜和锌混合物放入烧杯中再加入100克质量分数为10%的稀硫酸,在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设匀速进行,烧杯质量25g)
反应时间(m) | 2 | 4 | 6 | 8 | 10 |
烧杯和剩余物的质量(g) | 134.97 | m | 134.91 | 134.90 | 134.90 |
请计算:
(1)表中“m”为_____g;
(2)该锌混合物中锌的质量分数?_____(写过程)
【答案】134.94 32.5%
【解析】
(1)反应匀速进行,2分钟时烧杯和剩余物的质量为134.97g,6分钟时烧杯和剩余物的质量为134.91g,故4分钟时烧杯和剩余物的质量为134.94g。
(2)反应匀速进行,每两分钟生成氢气的质量为134.94g-134.97g=0.03g,反应前烧杯和剩余物的质量为134.97g+0.03g=135g,整个过程生成氢气的质量为135g-134.9g=0.1g,所加入铜和锌混合物的质量为135g-100g-25g=10g,设铜和锌混合物中锌的质量为想,则

![]()
解得x=3.25g;
该铜锌混合物中锌的质量分数为![]() 。
。

【题目】小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
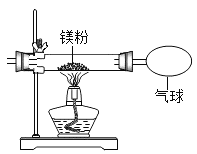
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(作出猜想)黄色固体是Mg3N2。
(实验探究)设计实验,验证猜想:
实验操作 | 实验现象及结论 |
__________ | ___________ |
(反思与交流)①空气中N2的含量远大于O2的含量,可是镁条在空气中的燃烧产物MgO却远多于Mg3N2,合理的解释是________。
②同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识________。
【题目】下表是氯化钠和硝酸钾在不同温度下的溶解度(假设硝酸钾与氯化钠同时溶解在水中各自的溶解度不变,实验过程中水分损失忽略不计)。
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 64.0 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
①硝酸钾和氯化钠的溶解度相同时的温度范围是_______;
A 0°C-20°C B 20°C-40°C C 40°C-60°C D 60°C-80°C
②20°C时,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是_______;要进一步提高该溶液的溶质质量分数,可进行的操作是_______。
③在80°C的100g水中溶解NaCl和KNO3,进行以下实验,己知溶液a中的硝酸钾恰好饱和:
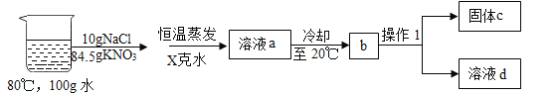
Ⅰ. 操作1的名称是______;
Ⅱ. X=_______克,固体C的成分和该成分的质量分别是______和________;
Ⅲ. 对整个实验过程分析正确的是________;
A 40°C-60°C开始析出晶体
B 氯化钠在整个过程中一直保持不饱和状态
C 上述方法不能将氯化钠和硝酸钾完全分离
D 原溶液直接降温结晶,析出硝酸钾的质量不变