题目内容
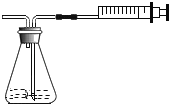
【题目】小颖同学为比较Mg、Fe、Cu三种金属的活动性顺序进行了如图甲所示的实验,实验后把两试管中的物质倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤,再向滤渣中加入适量稀盐酸, 产生无色气泡。根据上述信息,判断下列说法正确的是( )
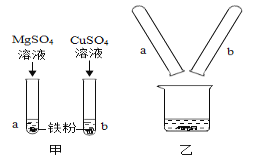
A.原a、b试管中溶液都一定呈浅绿色B.滤液中一定含有Mg2+、Fe2+,可能含有Cu2+
C.滤渣质量一定大于所加铁粉的总质量D.滤渣含有三种固体物质
【答案】BC
【解析】
![]() 三种金属的活动性顺序为
三种金属的活动性顺序为![]() ,铁粉和硫酸镁不反应,铁粉和硫酸铜反应生成铜和硫酸亚铁,发现烧杯内的红色固体明显增多,说明有铜生成,充分反应后过滤,若硫酸铜完全反应,溶液中的阳离子是镁离子和亚铁离子,若硫酸铜没有完全反应,溶液中的阳离子是镁离子、亚铁离子和铜离子。
,铁粉和硫酸镁不反应,铁粉和硫酸铜反应生成铜和硫酸亚铁,发现烧杯内的红色固体明显增多,说明有铜生成,充分反应后过滤,若硫酸铜完全反应,溶液中的阳离子是镁离子和亚铁离子,若硫酸铜没有完全反应,溶液中的阳离子是镁离子、亚铁离子和铜离子。
A、原a试管中铁粉和硫酸镁不反应,溶液是无色的,b试管中铁粉和硫酸铜反应生成铜和硫酸亚铁,溶液呈浅绿色,故A不正确;
B、若硫酸铜完全反应,溶液中的阳离子是镁离子和亚铁离子,若硫酸铜没有完全反应,溶液中的阳离子是镁离子、亚铁离子和铜离子,则滤液中一定含有![]() ,可能含有
,可能含有![]() ,故B正确;
,故B正确;
C、铁和硫酸铜反应生成硫酸亚铁和铜,56份铁置换出64份铜,质量增加,则滤渣质量一定大于所加铁粉的总质量,故C正确;
D、滤渣含有铁和铜两种固体物质,故D不正确。故选BC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】食盐是人类生存的必需品,获取食盐的途径有多种。
(1)开采岩盐,地下盐层含氯化钠等物质。配置某氯化钠溶液需85mL水,应选用______________mL量简量取(选填编号)。
A.10 B.20 C.100
(2)熬制井盐。《天工开物》记载:抽取深井中的盐水,用井中产生的天然气作为燃料熬制井盐。其燃烧的化学方程式是______________。氯化钠与硝酸钠的溶解度曲线如图,20℃时溶解度较小的物质是______________。

(3)海水晒盐。某地海水中主要物质的含量见表。
物质 | 每100g海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
… | … |
①该海水中氯化钠的质量分数为______________(精确到小数点后1位)。
②从食盐水中获得食盐的方法为______________;该实验操作中玻璃棒的作用是______________。
③除去氯化钠中的氯化钙应选用的试剂是______________。