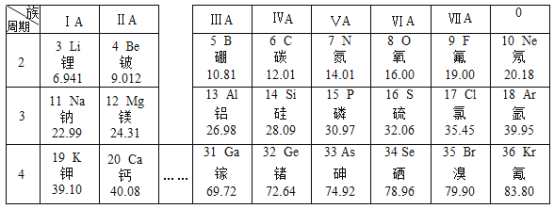
题目内容
【题目】利用下列实验来制取CO2并进行相关实验探究。
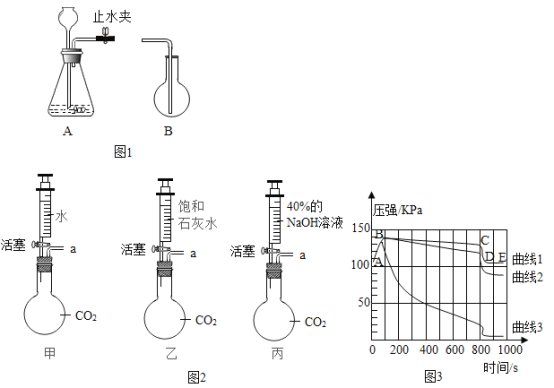
(1)制取CO2。
①简述检查A装置气密性的方法:_____。
②用B装置(烧瓶)收集CO2时,如何证明CO2已经收集满了?_____
(2)探究CO2的性质,实验步骤如下:
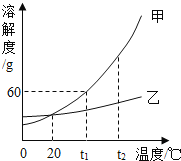
步骤1:图2所示装置的气密性良好(图中a处连接气体压力传感器),甲、乙、丙一个烧瓶容积均为250 mL,分别收集满CO2,三个注射器内各装有85mL液体。
步骤2:同时迅速将注射器内液体全部注入烧瓶中,关闭活塞;一段时间后,同时振荡烧瓶。
步骤3:利用“数字化实验”得到如图3所示的甲、乙、丙三个烧瓶内压强与时间的对应关系曲线1、2、3。
①烧瓶乙中有白色沉淀生成,该反应的化学方程式为:_____。
②曲线1中 BC段气压逐渐变小的原因是_____,曲线2与曲线3差别较大的原因是什么?_____。
③对比曲线1与曲线3,不能得出的结论是_____(填序号)。
a.CO2能溶于水 b.CO2能与水发生反应 c.CO2能与 NaOH 溶液发生反应
④请设计实验,证明反应进行到400s时,烧瓶丙的溶液中溶质的成分。
(3)向盛有12g石灰石(杂质不参与反应)样品的锥形瓶中加入100g稀盐酸,充分反应后,测得溶液呈酸性,锥形瓶内固体与溶液的总质量为107.6g,请计算样品中碳酸钙的质量分数(结果精确到0.1%)。_____
【答案】用弹簧夹夹紧橡皮管,向锥形瓶中注水,若形成一段稳定的水柱,说明气密性良好 将燃着的木条放到瓶口,木条熄灭,证明二氧化碳收集满 ![]() 二氧化碳溶于水 二氧化碳和氢氧化钠溶液反应,氢氧化钠溶液吸收二氧化碳比氢氧化钙溶液吸收二氧化碳更多,所以导致曲线2与曲线3差别较大 b 83.3%
二氧化碳溶于水 二氧化碳和氢氧化钠溶液反应,氢氧化钠溶液吸收二氧化碳比氢氧化钙溶液吸收二氧化碳更多,所以导致曲线2与曲线3差别较大 b 83.3%
【解析】
二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠和水。
①检查A装置气密性的方法是用弹簧夹夹紧橡皮管,向锥形瓶中注水,若形成一段稳定的水柱,说明气密性良好。
②二氧化碳不燃烧也不支持燃烧,所以用B装置(烧瓶)收集CO2时,证明CO2已经收集满的方法:将燃着的木条放到瓶口,木条熄灭,证明二氧化碳收集满。
(2)①二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为![]() 。
。
②图2中AB段气压快速增大的原因是注射器中的液体迅速加入烧瓶中;曲线1变化幅度最小,则是装置甲,BC段气压逐渐变小的原因是二氧化碳溶于水,振荡烧瓶使二氧化碳反应的速率加快,气体的体积变小,导致压强变小,所以导致CD段气压快速变小的操作是振荡,曲线2与曲线3差别较大的原因是二氧化碳和氢氧化钠溶液反应,氢氧化钠溶液吸收二氧化碳比氢氧化钙溶液吸收二氧化碳更多,所以导致曲线2与曲线3差别较大。
③a、曲线1说明CO2能溶于水,故a正确;
b、曲线1和曲线3都不能说明CO2能与水发生反应,故b不正确;
c、曲线1和曲线3对比,说明CO2能与NaOH溶液发生反应,故c正确。故选b。
④反应进行到400s时,由于二氧化碳和氢氧化钠反应生成碳酸钠,此时需要确定是否有剩余的氢氧化钠,所以就是检验是由为碳酸钠和氢氧化钠的混合物,过程中先检验并除去碳酸钠,然后检验溶液的酸碱性确定是否含有氢氧化钠,具体操作为取锥形瓶内溶液少量于试管中,加入足量的CaCl2溶液,有白色沉淀生成,说明原溶液中含有碳酸钠,向上层清液中加入酚酞溶液,溶液变红,说明原溶液中含有氢氧化钠。
(3)设样品中碳酸钙的质量为x
反应生成的CO2的质量为![]()
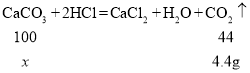
![]()
![]()
样品中碳酸钙的质量分数![]()
答:样品中碳酸钙的质量分数为83.3%。