题目内容
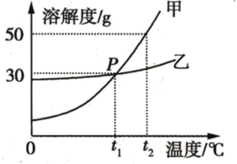
【题目】已知如图为甲、乙两种物质(不含结晶水)的溶解度曲线图,将t1℃时甲、乙的饱和溶液升温至t2℃,则两种溶液的溶质质量分数的关系为甲______(选填“>”“<”或“=”)乙;t2℃时,若甲溶液中溶质与溶剂的质量比为2 : 5,则该溶液为__ (选填“饱和”“不饱和”)溶液;t1℃将130 g乙溶液加水稀释为10%的溶液,需加水的质量为______g。
【答案】= 不饱和 170
【解析】
因为t1℃时甲、乙的溶解度相同,所以甲、乙的饱和溶液的溶质质量分数也相同,将t1℃时甲、乙的饱和溶液升温至t2℃,虽然甲、乙的溶解度都增大了,但溶质和溶剂均无改变,所以两种溶液的溶质质量分数的关系为相等。t2℃时,甲溶液中溶质与溶剂的质量比为2 : 5,根据溶解度概念,将溶质、溶剂质量等比例扩大20倍,则甲溶液中溶质与溶剂的质量比为40 : 100,即向100g水中加入的甲质量为40 g,但此时甲的溶解度为50g,因此该溶液为不饱和溶液。浓溶液加水稀释的过程中,不变的是溶质质量,因此建立等量关系:浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数。但此时缺少浓溶液的溶质质量分数,但题中关键词为“饱和溶液”,根据溶液曲线图可知,t1℃时溶液的溶解度为30g,则此时乙的饱和溶液的溶质质量分数为![]() ,设需加水的质量为x,则
,设需加水的质量为x,则![]() ,解得x=170 g。
,解得x=170 g。

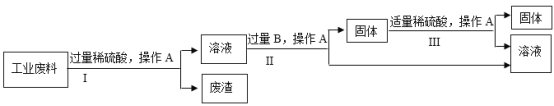
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)熟石灰主要成分的化学式是____________。
(2)溶液A中的阳离子是___________________(填离子符号)。
(3)沉淀C的成分是_____________________。
(4)溶液B与熟石灰反应的化学方程式是____________________________________。
【题目】在氢氧化钠溶液中逐滴滴加稀盐酸。实验过程中溶液温度的变化及实验操作如图一、图二所示:
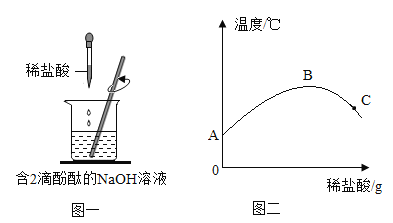
(1)在氢氧化钠溶液中滴加无色酚酞的作用是_____。
(2)根据图二所示:AB段曲线上升的原因是_____;C点时溶液中所含的阳离子有__。
(3)已知氢氧化钠稀溶液的浓度和相应的pH值如下表所示:
①根据下表推断,当溶液的pH值近似为12时,氢氧化钠溶液的溶质质量分数为___。
溶液中氢氧化钠的质量分数 | 近似pH值 |
4% | 14 |
0.4% | 13 |
12 | |
0.004% | 11 |
0.0004% | 10 |
②计算在50g溶质质量分数为4%的氢氧化钠溶液中,加入30g浓度为3.65%的稀盐酸,充分反应后所得溶液中氢氧化钠的质量分数为________,所得溶液的pH范围是_____ (填字母)。
A 10~11 B 11~12 C 12~13 D 13~14
(4)某造纸厂有10 t含NaOH的质量分数为3.2%的废水,现要用溶质质量分数为3.65%盐酸进行处理至中性后排放,需要这种盐酸的多少吨____?(废水中其他物质不与盐酸反应,写出计算过程)