题目内容
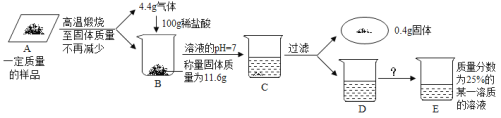
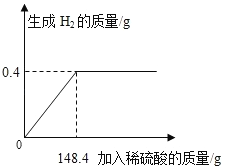
【题目】向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示。
求:
(1)样品中锌的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
【答案】(1)13g (2)20%
【解析】
试题本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况。根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算。
设样品中锌的质量为x,生成硫酸锌的质量为y,由图分析可知产生氢气0.4g
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g
![]() =
=![]() =
=![]()
x=13g y=32.2g
恰好完全反应时,所得溶液中溶质的质量分数=![]() ×100%=20%
×100%=20%
答:(1)样品中锌的质量为13g;(2)所得硫酸锌溶液中溶质的质量分数为20%

 备战中考寒假系列答案
备战中考寒假系列答案【题目】金属材料是人类社会发展的见证者,人类文明的发展和社会的进步同金属材料关系十分密切。
(一)生活中的金属
(1)没有镁的存在,就不能形成叶绿素,也就没有光合作用,这里的镁是指_____。
A 单质 B 元素 C 原子
(2)家用热水瓶内胆上的银白色金属是_____,传统血压计中的金属_____
(3)硬铝、不锈钢是常见的金属材料。它们属于_____(选填“合金”或“纯金属”)。
(4)为了减少和避免雷电对高层建筑的危害,需安装由金属材料制成的避雷装置,这主要是利用了金属材料的_____。(填序号)
A 密度大 B 导电性 C 导热性 D 熔点高
(二)一氧化碳还原氧化铁
(实验探究)兴趣小组设计了如图所示实验装置进行实验。将24.0g某种铁的氧化物粉末放入玻璃管中,充分反应后,得到黑色固体粉末。反应前后称量相关装置和物质的总质量,其数据如下表:

反应前 | 充分反应后 | |
Ⅰ 组 | 玻璃管和红色粉末的总质量为44.0g | 玻璃管和固体物质的总质量为36.8g |
Ⅱ 组 | 试管和所盛溶液的总质量为30.0g | 洗气瓶和瓶中物质 的总质量为32.1g |
(交流讨论)
(1)实验时应先通CO气体,其作用是_____。
(2)该实验装置有一明显的不妥,你认为是_____。
(3)实验数据应该选择_____ 组的实验数据计算来确定黑色粉末的成分,不选择另一组的理由是_____(答一点即可)。最终计算结果表明:铁的氧化物粉末粉化学式是_____。
(三)成分分析
(查阅资料)用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO![]() 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO![]() Fe+CO2。
Fe+CO2。
改进上述实验装置,并用温控加热装置代替酒精灯探究CO与一定量的氧化铁反应。加热时固体质量随温度变化的曲线如图所示。回答下列问题:
(1)温度控制在300℃﹣﹣500℃范围时,固体质量没有发生变化,原因是_____。
(2)图中H点对应的固体成分是_____
(3)图中M点对应a的质量=_____。
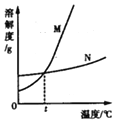
【题目】在不同温度时![]() 和KCl的溶解度如下表所示。请回答下列问题:
和KCl的溶解度如下表所示。请回答下列问题:
温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度 | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
依据数据绘制出溶解度曲线,图中能表示![]() 溶解度曲线的是______
溶解度曲线的是______![]() 填“M”或“N”
填“M”或“N”![]() ;温度t的范围是______;
;温度t的范围是______;![]() 时
时![]() 的KCl溶液蒸发______水
的KCl溶液蒸发______水![]() 或加入______KCl,答对一个即可
或加入______KCl,答对一个即可![]() ,可获得
,可获得![]() 的溶液。
的溶液。