题目内容
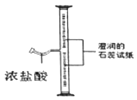
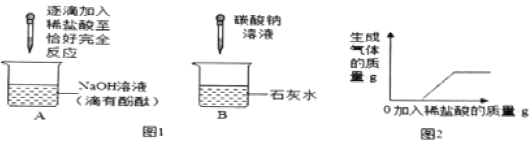
【题目】化学兴趣小组的同学在探究碱的化学性质时,完成了如图1所示的两个实验。实验后,小明同学将废液倒入同一废液缸中,发现混合废液浑浊并显红色。请你完成下列问题:
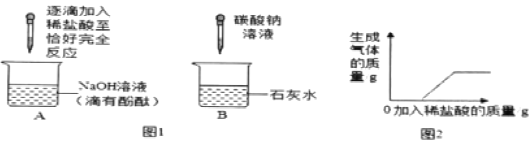
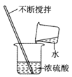
![]() 实验中发生反应的化学方程式是______。判断A实验中恰好完全反应的现象是______。
实验中发生反应的化学方程式是______。判断A实验中恰好完全反应的现象是______。
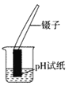
![]() 实验中发生的现象是______。
实验中发生的现象是______。
![]() (提出问题)废液中,能使酚酞溶液变红的物质可能是哪些呢?
(提出问题)废液中,能使酚酞溶液变红的物质可能是哪些呢?
(作出猜想)猜想一:废液中,能使酚酞溶液变红的物质可能是NaOH;
猜想二:废液中,能使酚酞试液变红的物质还可能是______;
猜想三:废液中,能使酚酞溶液变红的物质还可能是![]() 。
。
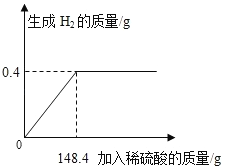
(实验验证)同学们对可能含有的碱性物质进行确定,取一定量的废液过滤,向滤液中逐滴加入稀盐酸,根据反应现象得到如图2所示的图象。
(结论)分析图象数据得出,废液中使酚酞变红的物质一定是______。一定不是______。
(拓展提高)为了使以上废液实现安全排放,你的做法是______。
【答案】NaOH+HCl=NaCl+H2O 红色恰好变为无色 澄清石灰水变浑浊 Na2CO3 碳酸钠和氢氧化钠 氢氧化钙 向废液中滴加适量的稀盐酸刚好由红色变成无色
【解析】
![]() 由实验可知,A实验中发生的反应是氢氧化钠与稀盐酸发生了中和反应,化学方程式是:NaOH+HCl=NaCl+H2O实验中恰好完全是溶液中既没有氢氧化钠,又没有稀盐酸,所以反应的现象是:红色恰好变为无色。
由实验可知,A实验中发生的反应是氢氧化钠与稀盐酸发生了中和反应,化学方程式是:NaOH+HCl=NaCl+H2O实验中恰好完全是溶液中既没有氢氧化钠,又没有稀盐酸,所以反应的现象是:红色恰好变为无色。
![]() 实验中发生的反应是碳酸钠与氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,所以B实验中发生的现象是:澄清石灰水变浑浊。
实验中发生的反应是碳酸钠与氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,所以B实验中发生的现象是:澄清石灰水变浑浊。
![]() 【作出猜想】实验结束后,同学们将废液倒入同一只废液缸中,发现废液显红色,NaOH、Ca(OH)2、NaCO3溶液都可使酚酞试液变红;故猜想二:废液中,能使酚酞试液变红的物质还可能是NaCO3,
【作出猜想】实验结束后,同学们将废液倒入同一只废液缸中,发现废液显红色,NaOH、Ca(OH)2、NaCO3溶液都可使酚酞试液变红;故猜想二:废液中,能使酚酞试液变红的物质还可能是NaCO3,
【结论】
通过图形可以看出滴加盐酸后,没有直接产生气体,滴加一定量的盐酸后有气体生成,说明一定有NaOH和NaCO3;Ca(OH)2和生成碳酸钙沉淀,说明一定没有
Ca(OH)2;
【拓展提高】
由上述分析可知废液中含有氢氧化钠和碳酸钠,为了使以上废液实现安全排放,做法是:向废液中滴加适量的稀盐酸刚好由红色变成无色,

【题目】阅读下面科普短文。
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。
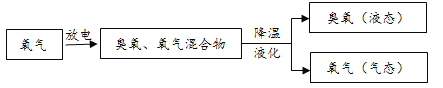
生产中大量使用的臭氧通常由如图所示方法制得。
臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表1所示。
表1 臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2mg/L) | 二次污染 | 投资成本 (900m3设备) | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | <5min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | >30min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题。
(1)氧气(O2)和臭氧(O3)沸点比较低的是_____。
(2)臭氧处理饮用水时,利用了臭氧的_____(填“物理”或“化学”)性质。
(3)依据表1信息,为了快速杀灭病毒,应选择的消毒剂是_____。
(4)下列关于臭氧的说法中,正确的是_____(填序号)。
A 臭氧的漂白作用比氯气强
B 由氧气制得臭氧的过程中,既有物理变化也有化学变
C 臭氧在生产生活中有很多用途,对人类有益无害
D 臭氧稳定性差,不利于储存,其应用可能会受到限制