题目内容
【题目】为测定某生石灰和石灰石(杂质不参加反应且不溶于水)样品中各成分的含量,探究小组进行了如下实验:
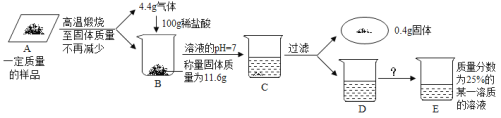
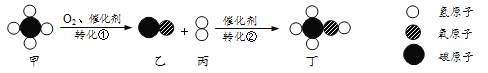
(1)实验中A→B发生反应的化学方程式为___;
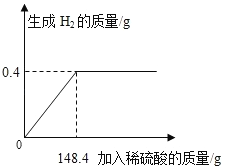
(2)求解实验中恰好完全反应的稀盐酸的溶质质量(x)的比例式为___;
(3)用36.5%的浓盐酸配制实验中所用的稀盐酸需加水的体积为___;
(4)若通过改变溶剂的方式得到E中一定质量的25%的某溶液,则D→E的操作及改变溶剂的质量为___;
(5)样品中碳酸钙的纯度为___;
(6)制取(成分及含量相同的)该样品64g,需要含杂质的石灰石的质量为___.
【答案】CaCO3![]() CaO+CO2↑
CaO+CO2↑ ![]() 60mL 22.4g 62.5% 81.6g
60mL 22.4g 62.5% 81.6g
【解析】
(1)实验中A→B过程中,碳酸钙分解生成氧化钙和二氧化碳,发生反应的化学方程式为:CaCO3![]() CaO+CO2↑.
CaO+CO2↑.
故填:CaCO3![]() CaO+CO2↑.
CaO+CO2↑.
(2)设恰好完全反应的稀盐酸的溶质质量为x,生成氯化钙质量为y,
参加反应的氧化钙质量为:11.6g﹣0 .4g=11.2g,

![]()
x=14.6g,y=22.2g,
故填:![]()
(3)需要36.5%的浓盐酸的质量为:14.6g÷36.5%=40g,
用36.5%的浓盐酸配制实验中所用的稀盐酸需加水的体积为:(100g﹣40g)÷1g/mL=60mL,
故填:60mL.
(4)参加反应的氧化钙质量为11.2g,根据质量守恒定律可知所得溶液E的质量=11.2g+100g=111.2g,D中溶质质量分数为:![]()
因此若通过改变溶剂的方式得到E中一定质量的25%的某溶液,则D→E的操作是蒸发,设蒸发水的质量为z,
根据题意有:![]() ×100%=25%,
×100%=25%,
z=22.4g,
故填:22.4g.
(5)设碳酸钙质量为m,生成氧化钙质量为n,

![]()
得m=10g,n=5.6g
样品中碳酸钙的纯度为;![]() ×100%=62.5%,而样品中氧化钙的纯度为:
×100%=62.5%,而样品中氧化钙的纯度为:![]() ×100%=35%
×100%=35%
故填:62.5%.
(6)制取(成分及含量相同的)该样品64g,所含氧化钙的质量为64g×35%=22.4g
设生成22.4g氧化钙时生成的二氧化碳的质量为a

44/56=a/22.4g
a=17.6g
需要含杂质的石灰石的质量为64g+17.6g=81.6g
故填:81.6g.

【题目】阅读下面科普短文。
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。
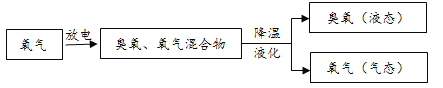
生产中大量使用的臭氧通常由如图所示方法制得。
臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表1所示。
表1 臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2mg/L) | 二次污染 | 投资成本 (900m3设备) | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | <5min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | >30min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题。
(1)氧气(O2)和臭氧(O3)沸点比较低的是_____。
(2)臭氧处理饮用水时,利用了臭氧的_____(填“物理”或“化学”)性质。
(3)依据表1信息,为了快速杀灭病毒,应选择的消毒剂是_____。
(4)下列关于臭氧的说法中,正确的是_____(填序号)。
A 臭氧的漂白作用比氯气强
B 由氧气制得臭氧的过程中,既有物理变化也有化学变
C 臭氧在生产生活中有很多用途,对人类有益无害
D 臭氧稳定性差,不利于储存,其应用可能会受到限制