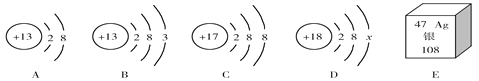
题目内容
【题目】如图是某品牌补铁片标签上的部分文字说明。计算:
(1)硫酸亚铁的相对分子质量_____;
(2)硫酸亚铁中各原子的个数比为_____;
(3)硫酸亚铁中铁、硫、氧三种元素质量比为_____(化成最简整数比);
(4)硫酸亚铁中铁元素质量分数为_____(保留0.1%);
(5)该补铁片中铁元素的质量分数是多少?_______(保留0.1%)(写出计算过程,下同)
(6)按照说明书服用补铁片时,成人每天补充铁元素质量为多少mg?______(保留整数)
(7)若某FeSO4和Fe2(SO4)3的混合物中氧元素的质量分数为42%,则该混合物中铁的质量分数为多少?_________;

【答案】152铁、硫、氧原子的个数比为1:1:47:4:836.8%18.7%(详见解析)168mg(详见解析)37%(详见解析)
【解析】
(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答;
(2)根据化合物化学式的意义进行分析;
(3)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;
(4)根据化合物中元素的质量分数公式进行分析解答;
(5)根据每片硫酸亚铁片中铁元素的质量以及硫酸亚铁片的质量即可求出每片硫酸亚铁片中铁元素的质量分数;
(6)根据每天服用硫酸亚铁片的质量以及铁元素的质量分数即可求出每天能够补充的铁元素的质量进行解答;
(7)根据FeSO4和Fe2(SO4)3两种物质的组成特点,可知混合物中S元素的原子与O元素的原子个数比为1:4,进行分析解答。
(1)硫酸亚铁的相对分子质量为56+32+16×4=152;
(2)由化学式可知,硫酸亚铁中铁、硫、氧原子的个数比为1:1:4;
(3)硫酸亚铁中铁、硫、氧三种元素的质量比56:32:(16×4)=7:4:8;
(4)硫酸亚铁中铁元素的质量分数为 ![]() =36.8%;
=36.8%;
(5)0.3g=300mg,每片硫酸亚铁片中铁元素的质量分数= ![]() =18.7%;
=18.7%;
(6)每天能够补充的铁元素的质量=152mg×3×![]() =168mg;
=168mg;
(7)在FeSO4和Fe2(SO4)3组成的混合物中, S元素的原子与O元素的原子个数比为1:4,硫元素和氧元素的质量比是定值,所以硫元素与氧元素的质量比=32:(16×4)=1:2;由于混合物中氧元素的质量分数为42%,则混合物中硫元素的质量分数=42%÷2=21%。
则混合物中铁元素的质量分数=1﹣21%﹣42%=37%。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案