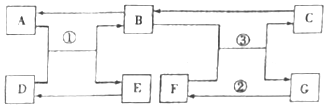
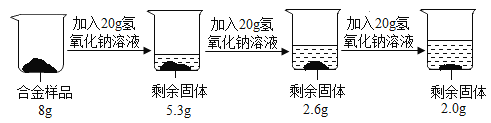
题目内容
【题目】固体氢氧化钠放置在空气中容易变质转化为碳酸钠。现称取一久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成119.7g溶液,向其中滴加质量分数为8.55%的氢氧化钡溶液,产生沉淀与所加氢氧化钡溶液的质量关系如图所示。请通过计算回答:
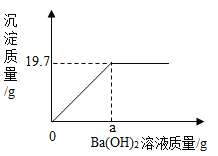
(1)该烧碱样品变质的程度为_____(填“部分变质”或“全部变质”)。
(2)a=_____g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?=_____(写出计算过程,计算结果精确到0.01%)
【答案】全部变质 200 2.67%
【解析】
解:设生成的氢氧化钠的质量为x,消耗的碳酸钠的质量为y,消耗氢氧化钡溶液的质量为z。
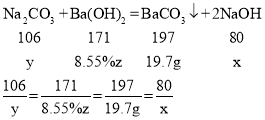
解得x=8g,y=10.6g,z=200g。
(1)则加入的10.6g物质均为碳酸钠,所以该烧碱样品完全变质。
(2)通过计算可知,恰好完全反应时,消耗氢氧化钡溶液的质量为200g。
(3)沉淀刚好达到最大值时,溶液中溶质质量分数为:![]() 。
。

练习册系列答案
相关题目