题目内容
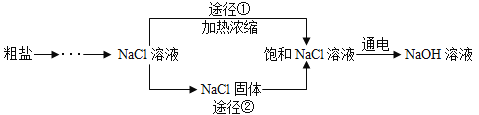
【题目】如图是模拟海水制盐的流程。

(1)操作 a 所需要的玻璃仪器有________________。
(2)如何用实验证明第①步所加的 Ca(OH)2溶液已过量?_________________。
(3)实验过程中,滤液的成分除了含有水和氯化钠外,还含有_______________。
(4)为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质,请写出其中一个反应的化学方程式:_______________。如果要将精盐水继续提纯成 NaCl 晶体,应进行的操作是_________________。
【答案】玻璃棒、烧杯、漏斗 取少量加入Ca(OH)2溶液后的上层清液于试管中,滴加氢氧化钙溶液,观察是否有沉淀生成,若无沉淀生成,则第①步所加的 Ca(OH)2溶液已过量,反之,第①步所加的 Ca(OH)2溶液未过量 氢氧化钠,碳酸钠 ![]() 或
或![]() 蒸发结晶
蒸发结晶
【解析】
(1)操作 a可以分离固、液混合物,为过滤操作,需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗;
(2)第①步所加的 Ca(OH)2是为了除去氯化镁,若氢氧化钙过量则氯化镁已经除尽,反之则未除尽,氯化镁可以与氢氧化钙反应生成氢氧化镁沉淀和氯化钙。证明第①步所加的 Ca(OH)2溶液已过量的方法是:取样,继续加氢氧化钙溶液观察现象。故填:取少量加入Ca(OH)2溶液后的上层清液于试管中,滴加氢氧化钙溶液,观察是否有沉淀生成,若无沉淀生成,则第①步所加的 Ca(OH)2溶液已过量,反之,第①步所加的 Ca(OH)2溶液未过量。
(3)第①步所加过量的氢氧化钙会与碳酸钠生成氢氧化钠,且第②步所加碳酸钠过量,故填:氢氧化钠,碳酸钠;
(4)加盐酸可以除去氢氧化钠和碳酸钠,故填:![]() 或
或![]() 。氯化钠的溶解度受温度影响较小,常采用蒸发结晶的方法进行提纯,要将精盐水继续提纯成 NaCl 晶体,应进行的操作是蒸发结晶。
。氯化钠的溶解度受温度影响较小,常采用蒸发结晶的方法进行提纯,要将精盐水继续提纯成 NaCl 晶体,应进行的操作是蒸发结晶。