题目内容
【题目】小新和小明同学用镁带燃烧的实验来探究质量守恒定律:
(1)镁带在空气中燃烧的化学方程式为_____;
(2)小新认为:镁带完全燃烧后,剩余固体质量要比参加反应的镁带质量大,理由是_____;
(3)而小明认为:镁带完全燃烧后,剩余固体质量要比参加反应的镁带质量小,理由是_____;
(4)小新查阅资料知:镁不仅能在氧气中燃烧,也能在二氧化碳中燃烧。于是他将点燃的镁条放入盛满二氧化碳的集气瓶中,发现镁条剧烈燃烧,产生大量白烟,瓶壁有黑色物质生成,请写出这个反应的化学方程式_____。
【答案】2Mg+O2![]() 2MgO 镁与氧气化合生成氧化镁,生成物质量肯定要比参加反应的镁带质量大 带燃烧生成的氧化镁有部分以白烟形式扩散到空气中,剩余固体质量要比参加反应的镁带质量小 2Mg+CO2
2MgO 镁与氧气化合生成氧化镁,生成物质量肯定要比参加反应的镁带质量大 带燃烧生成的氧化镁有部分以白烟形式扩散到空气中,剩余固体质量要比参加反应的镁带质量小 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
①镁和氧气在点燃的条件下生成氧化镁,化学方程式为:2Mg+O2![]() 2MgO。
2MgO。
②根据质量守恒定律,镁燃烧后剩余固体质量增加,实际上增加了参加反应的氧气的质量,参加反应镁的质量和氧气的质量等于反应后生成氧化镁的质量。
③镁和氧气反应,在生成氧化镁的同时,白烟会带走一部分的氧化镁,故剩余固体质量要比参加反应的镁带质量小。
④根据质量守恒定律,镁在二氧化碳中反应生成的白烟应当是氧化镁,黑色的物质应当是碳,故反应方程式为:2Mg+CO2![]() 2MgO+C。
2MgO+C。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请把以下探究过程补充完全.
(作出猜想):1.Cr>Fe>Cu 2. Fe>Cu>Cr 3.________.
(查阅资料)(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
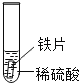
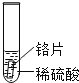
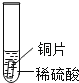
(设计与实验)小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种浓度的稀硫酸.
实验 | 试管1 | 试管2 | 试管3 |
实验操作 |
|
|
|
实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | 无明显现象 |
(结论与解释)(1)小聪得到的结论是猜想________ 正确.
(2)实验前用砂纸打磨金属片的目的是________.
(知识运用)如果将光洁的铬片投入到CuSO4溶液中,反应的现象为______.反应的化学方程式为_______.
【题目】课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,某探究小组据此设计了如下探究方案。
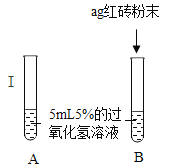
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能带火星木条复燃的气体。 | ①产生的气体是____。 ②红砖粉末能改变过氧化氢分解速率。 |
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ①又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的_____和_____在反应前后均没有发生变化,能作过氧 化氢分解的催化剂 |
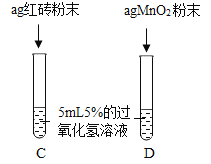
Ⅲ. | 两试管中均产生气泡 且_____________________ | 红砖粉末的催化效果没有二氧化锰粉末好 |
(实验拓展)查阅资料得知:硫酸铜、猪肝、土豆等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法正确的是________。
A催化剂只能加快化学反应的速率
B催化剂能增加生成物的质量
C同一个化学反应可以有多种催化剂