题目内容
【题目】下列图象能正确反映对应变化关系的是( )
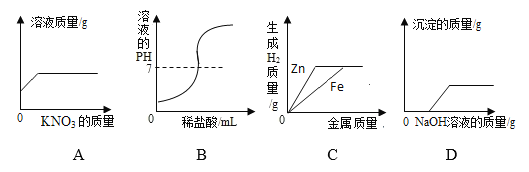
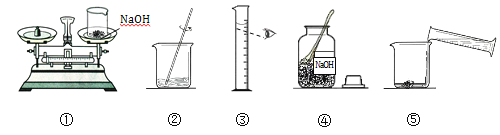
A. 在一定温度下,向不饱和的硝酸钾溶液中不断加入硝酸钾固体,充分搅拌
B. 向NaOH溶液中逐滴加入稀盐酸
C. 将一定质量的稀硫酸平均分为两份,分别向其中加入足量的金属Zn和Fe
D. 在一定量的CuSO4和HCl溶液中逐滴加入NaOH溶液
【答案】AD
【解析】A. 饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。在一定温度下,向不饱和的硝酸钾溶液中不断加入硝酸钾固体,充分搅拌,开始时会溶解硝酸钾,溶质的质量分数增大,达到饱和后,质量分数不再改变;B. 向NaOH溶液中逐滴加入稀盐酸,开始使溶液的pH大于7,随着酸的加入pH逐渐变小,酸过量时,pH小于7;C. 将一定质量的稀硫酸平均分为两份,分别向其中加入足量的金属Zn和Fe,反应中,等质量的锌比铁生成氢气少,反应结束时氢气的质量由酸决定,因酸一定反应完,同质量的酸,生成氢气一样多;D. 在一定量的CuSO4和HCl溶液中逐滴加入NaOH溶液,由于氢氧化铜可以被盐酸反应掉,所以加入的氢氧化钠先与盐酸反应,盐酸反应完,氢氧化钠再与硫酸铜反应,生成氢氧化铜沉淀。答案为AD

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】某小组同学利用比较方法对二氧化碳和二氧化硫的某些性质进行了初步探究。
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与品红溶液等某些有色物质反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在;二氧化硫可使酸性高锰酸钾溶液褪色,常用酸性高锰酸钾溶液除去二氧化碳中的二氧化硫。
【理论分析】(1)二氧化硫能引起酸雨,所以二氧化硫溶于水后,溶液显酸性。
(2)从物质分类角度,二氧化硫和二氧化碳都属于_________。
【设计与实验】
序号 | 操作 | 现象 | 分析与结论 |
1 | 用规格相同的两个软塑料瓶分别收集满二氧化硫和二氧化碳,然后加入等体积水(约占塑料瓶容积的三分之一)后,塞紧瓶塞振荡 | 两个塑料瓶都变瘪,且收集有二氧化硫的塑料瓶变得更瘪 | __________________ |
2 | 用两支试管分别取1中两个瓶中的液体,分别滴入紫色石蕊溶液, | ___________________ | 二氧化碳和二氧化硫溶于水所得溶液都显酸性 |
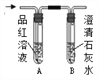
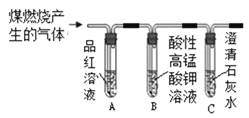
3 | 分别将二氧化碳和二氧化硫通入下列装置中
| 通过入二氧化碳时,A中无明显现象,B中_____________; 通入二氧化硫时,A中溶液由红色变成无色,B中液体变浑浊 | 二氧化硫可使品红溶液褪色,二氧化硫能使澄清石灰水变浑浊,通入二氧化碳后,B中反应的化学方程式为_______________ |
4 | 将3中通入二氧化硫后,试管A中无色液体加热 | 溶液又变成红色 | 溶液变成红色的原因是______________ |
【结论】二氧化碳和二氧化硫有一些相似的性质,但两者的性质不完全相同。
【拓展】小组同学设计如图所示装置,检验煤燃烧产物中既有二氧化碳,也有二氧化硫,实验中除可观察到B溶液变浅,但仍然有颜色外,还可观察到的现象有_________________。
【题目】以下是两个常见的工业流程,

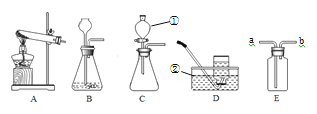
流程一:从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,生产流程如下:
(1)加入过量的A物质,该A物质为______。操作a的名称是 _______,操作a所用到的玻璃仪器有烧杯、玻璃棒、_________,操作a中玻璃棒的作用是 _______ 。
(2)写出流程图中的固体成分的化学式 ____ ,B的溶液中溶质的化学式 _______
流程二:如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略),请回答下列问题:
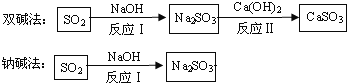
(1)CaSO3中Ca、S、O元素的质量比是_______。
(2)已知原料NaOH的价格为2.9元/kg. 而Ca(OH)2的价格为0.36元/kg.两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是______________。
【答案】 铁 过滤 漏斗 引流 Fe和Cu H2SO4 5:4 : 6 双碱法中通过反应II实现了NaOH的循环利用,减少了NaOH的用量 处理等量SO2,氢氧化钙用量更少且价格便宜,所以双碱法成本更低
【解析】流程一:只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,所所加试剂是过量的铁,反应方程式为Fe+CuSO4==FeSO4+Cu ,反应后得到是固体铜和铁,溶液硫酸亚铁溶液,过滤可将难溶固体与液体分离,所以应过滤,过滤用到的仪器有:烧杯、漏斗、玻璃棒、铁架台,其中,玻璃棒的作用是引流;将铜和铁的混合物中的铁除掉,得硫酸亚铁和铜,所以应加入的试剂B为稀硫酸,因为.Fe+H2SO4=FeSO4+H2↑,而铜和酸不反应;流程二:(1)化合物中元素的质量比=(相对原子质量×原子个数)之比,CaSO3中Ca、S、O元素的质量比是40:32:3×16= 5:4 : 6;(2)Na2SO3 + Ca(OH)2 = CaSO3↓+2NaOH , 2NaOH+ SO2 == Na2SO3+ H2O;因此用双碱法(氢氧化钙和氢氧化钠联合使用)实现了NaOH的循环利用,减少了NaOH的用量 处理等量SO2,氢氧化钙用量更少且价格便宜,所以双碱法成本更低。
【题型】流程题
【结束】
26
【题目】碱式碳酸镁密度小,是橡胶制品的优良填料。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
【探究一】碱式碳酸镁的制备
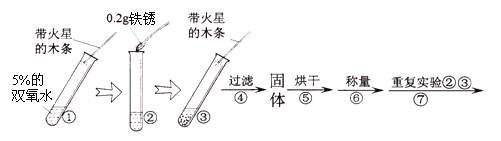
碱式碳酸镁可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如下图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
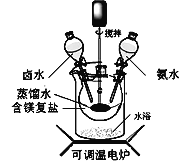
回答下列问题:
(1)搅拌的目的是________。
(2)设计实验检验碱式碳酸镁中含有Cl-
实验操作 | 实验现象 | 实验结论 |
①取样溶解,向样品溶液中滴加过量稀硝酸。 ②再向上述所得溶液加____溶液 | 现象①____; 现象②____; | 含有 Cl- |
【探究二】探究小组利用下图测定xMgCO3·yMg(OH)2·zH2O组成。已知:
(1)碱石灰的主要成分为氢氧化钠和生石灰,能吸收水蒸气和二氧化碳;
(2)碱式碳酸镁分解反应方程式为:xMgCO3·yMg(OH)2·zH2O === (x+y)MgO + xCO2↑+ (y+z) H2O
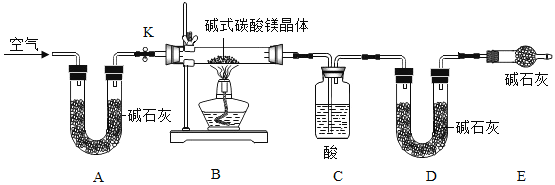
实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:______(请补充该步操作内容)。
步骤5:称量相关装置的质量。
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0 g B.反应后玻璃管与残留固体总质量120.0 g
C.装置C实验后增重9.0 g D.装置D实验后增重17.6 g
回答下列问题:
(1)检查整套实验装置气密性:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中,打开活塞K,对装置B用酒精灯微热,若观察到____,则气密性良好;
(2)装置A的作用是____,如果没有装置A,则测定得到xMgCO3·yMg(OH)2·zH2O中的z值____(填“偏大”、“偏小”、“无影响”),装置C中的酸为___(写名称);
(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3·yMg(OH)2·zH2O)中x∶y∶z的最简整数比是_(要求写出过程)。