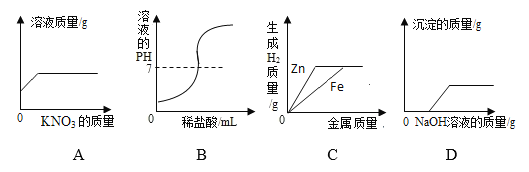
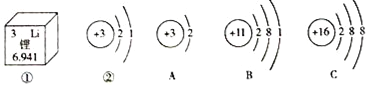
题目内容
【题目】以下是两个常见的工业流程,

流程一:从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,生产流程如下:
(1)加入过量的A物质,该A物质为______。操作a的名称是 _______,操作a所用到的玻璃仪器有烧杯、玻璃棒、_________,操作a中玻璃棒的作用是 _______ 。
(2)写出流程图中的固体成分的化学式 ____ ,B的溶液中溶质的化学式 _______
流程二:如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略),请回答下列问题:
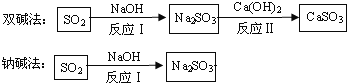
(1)CaSO3中Ca、S、O元素的质量比是_______。
(2)已知原料NaOH的价格为2.9元/kg. 而Ca(OH)2的价格为0.36元/kg.两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是______________。
【答案】 铁 过滤 漏斗 引流 Fe和Cu H2SO4 5:4 : 6 双碱法中通过反应II实现了NaOH的循环利用,减少了NaOH的用量 处理等量SO2,氢氧化钙用量更少且价格便宜,所以双碱法成本更低
【解析】流程一:只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,所所加试剂是过量的铁,反应方程式为Fe+CuSO4==FeSO4+Cu ,反应后得到是固体铜和铁,溶液硫酸亚铁溶液,过滤可将难溶固体与液体分离,所以应过滤,过滤用到的仪器有:烧杯、漏斗、玻璃棒、铁架台,其中,玻璃棒的作用是引流;将铜和铁的混合物中的铁除掉,得硫酸亚铁和铜,所以应加入的试剂B为稀硫酸,因为.Fe+H2SO4=FeSO4+H2↑,而铜和酸不反应;流程二:(1)化合物中元素的质量比=(相对原子质量×原子个数)之比,CaSO3中Ca、S、O元素的质量比是40:32:3×16= 5:4 : 6;(2)Na2SO3 + Ca(OH)2 = CaSO3↓+2NaOH , 2NaOH+ SO2 == Na2SO3+ H2O;因此用双碱法(氢氧化钙和氢氧化钠联合使用)实现了NaOH的循环利用,减少了NaOH的用量 处理等量SO2,氢氧化钙用量更少且价格便宜,所以双碱法成本更低。
【题型】流程题
【结束】
26
【题目】碱式碳酸镁密度小,是橡胶制品的优良填料。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
【探究一】碱式碳酸镁的制备
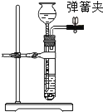
碱式碳酸镁可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如下图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。
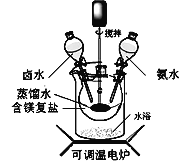
回答下列问题:
(1)搅拌的目的是________。
(2)设计实验检验碱式碳酸镁中含有Cl-
实验操作 | 实验现象 | 实验结论 |
①取样溶解,向样品溶液中滴加过量稀硝酸。 ②再向上述所得溶液加____溶液 | 现象①____; 现象②____; | 含有 Cl- |
【探究二】探究小组利用下图测定xMgCO3·yMg(OH)2·zH2O组成。已知:
(1)碱石灰的主要成分为氢氧化钠和生石灰,能吸收水蒸气和二氧化碳;
(2)碱式碳酸镁分解反应方程式为:xMgCO3·yMg(OH)2·zH2O === (x+y)MgO + xCO2↑+ (y+z) H2O
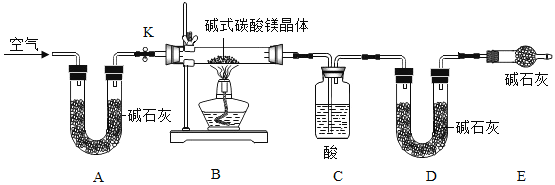
实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:______(请补充该步操作内容)。
步骤5:称量相关装置的质量。
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0 g B.反应后玻璃管与残留固体总质量120.0 g
C.装置C实验后增重9.0 g D.装置D实验后增重17.6 g
回答下列问题:
(1)检查整套实验装置气密性:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中,打开活塞K,对装置B用酒精灯微热,若观察到____,则气密性良好;
(2)装置A的作用是____,如果没有装置A,则测定得到xMgCO3·yMg(OH)2·zH2O中的z值____(填“偏大”、“偏小”、“无影响”),装置C中的酸为___(写名称);
(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3·yMg(OH)2·zH2O)中x∶y∶z的最简整数比是_(要求写出过程)。
【答案】 反应物充分混合接触,提高反应速率 产生气泡 再向上述所得溶液加硝酸银或AgNO3溶液 产生白色沉淀 打开活塞K,再次鼓入空气 两端导管口处均出现气泡 吸收空气中的水和二氧化碳防止干扰C、D装置 偏大 浓硫酸 4:1:4
【解析】根据所学知识和题中信息知,(1)搅拌的目的是反应物充分混合接触,提高反应速率。(2)设计实验检验碱式碳酸镁中含有Cl-。
实验操作 | 实验现象 | 实验结论 |
①取样溶解,向样品溶液中滴加过量稀硝酸。 ②再向上述所得溶液加硝酸银或AgNO3溶液 | 现象①产生气泡; 现象②产生白色沉淀,银离子与氯离子生成氯化银白色沉淀; | 含有 Cl- |
【探究二】测定xMgCO3·yMg(OH)2·zH2O组成。(1)碱石灰的主要成分为氢氧化钠和生石灰,能吸收水蒸气和二氧化碳;(2)碱式碳酸镁分解反应方程式为:xMgCO3·yMg(OH)2·zH2O ![]() (x+y)MgO + xCO2↑+ (y+z) H2O。步骤4:打开活塞K,再次鼓入空气。测得数据:A、反应前玻璃管的质量100.0 g ;B、反应后玻璃管与残留固体总质量120.0 g;C.装置C实验后增重9.0 g;D、装置D实验后增重17.6 g。(1)检查整套实验装置气密性:若观察到两端导管口处均出现气泡,则气密性良好。(2)装置A的作用是吸收空气中的水和二氧化碳防止干扰,碱石灰的主要成分为氢氧化钠和生石灰,能吸收水蒸气和二氧化碳。如果没有装置A,则测定得到xMgCO3·yMg(OH)2·zH2O中的z值偏大,空气中有水蒸气。装置C中的酸为浓硫酸,具有吸水性。
(x+y)MgO + xCO2↑+ (y+z) H2O。步骤4:打开活塞K,再次鼓入空气。测得数据:A、反应前玻璃管的质量100.0 g ;B、反应后玻璃管与残留固体总质量120.0 g;C.装置C实验后增重9.0 g;D、装置D实验后增重17.6 g。(1)检查整套实验装置气密性:若观察到两端导管口处均出现气泡,则气密性良好。(2)装置A的作用是吸收空气中的水和二氧化碳防止干扰,碱石灰的主要成分为氢氧化钠和生石灰,能吸收水蒸气和二氧化碳。如果没有装置A,则测定得到xMgCO3·yMg(OH)2·zH2O中的z值偏大,空气中有水蒸气。装置C中的酸为浓硫酸,具有吸水性。
(3)xMgCO3·yMg(OH)2·zH2O ![]() (x+y)MgO + xCO2↑+ (y+z) H2O
(x+y)MgO + xCO2↑+ (y+z) H2O
40(x+y) 44x 18(y+z)
120.0g﹣100.0g 17.6g 9.0g
![]() =
=![]() =
=![]()
x∶y∶z=4:1:4
点睛∶这是一道实验探究题,浓硫酸具有吸水性;碱石灰的主要成分为氢氧化钠和生石灰,能吸收水蒸气和二氧化碳。为保证实验的准确性,装置两端均装有盛碱石灰装置,以防空气中二氧化碳和水进入,干扰实验结果。

【题目】小明来到实验室完成氧气和二氧化碳气体的制取实验,请按照要求答问题:
①实验台前有如图甲仪器和药品,请写出仪器A的名称:A______
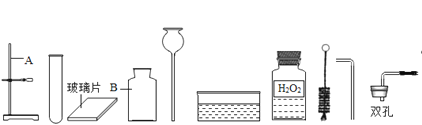
小明利用上述仪器和药品可以做制取氧气的实验,实验前她发现其中缺少一种药品,该药品名称是______;该反应的原理是(用化学方程式表示)______________________.
②下表是小明制取二氧化碳气体的主要步骤及相关实验装置,其中______(填字母序号)步骤中的实验装置有错误,改正的方法是_________________________________.
改正后进行实验,这些步骤的正确操作顺序是____________________(填字母序号)
实验步骤 | a.制备气体 | b.收集气体 | c.检查装置气密性 | d.清洗仪器、整理桌面 |
相关实验装置 |
|
|
|
|
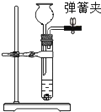
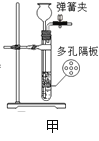
③上述装置改进成下图甲装置制取二氧化碳气体,甲装置的优点是______________。请简述甲装置中长颈漏斗的作用___________。
④下图乙是一个气密性良好的启普发生器也可制取二氧化碳气体,反应一段时间后关闭活塞K,不可能观察到的现象是_________
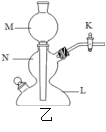
A、固液接触,无气泡产生
B、固液接触,仍有气泡产生
C、M中液面不断下降,N中液面不断上升
D、N中液面下降至L中
⑤用大理石和稀盐酸反应制备CO2,滴加盐酸后,产生了4.4g二氧化碳,这些二氧化碳的物质的量为_______,计算反应消耗HCl的物质的量_______。(根据化学方程式列式计算)。