题目内容
【题目】某小组同学利用比较方法对二氧化碳和二氧化硫的某些性质进行了初步探究。
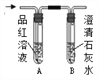
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与品红溶液等某些有色物质反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在;二氧化硫可使酸性高锰酸钾溶液褪色,常用酸性高锰酸钾溶液除去二氧化碳中的二氧化硫。
【理论分析】(1)二氧化硫能引起酸雨,所以二氧化硫溶于水后,溶液显酸性。
(2)从物质分类角度,二氧化硫和二氧化碳都属于_________。
【设计与实验】
序号 | 操作 | 现象 | 分析与结论 |
1 | 用规格相同的两个软塑料瓶分别收集满二氧化硫和二氧化碳,然后加入等体积水(约占塑料瓶容积的三分之一)后,塞紧瓶塞振荡 | 两个塑料瓶都变瘪,且收集有二氧化硫的塑料瓶变得更瘪 | __________________ |
2 | 用两支试管分别取1中两个瓶中的液体,分别滴入紫色石蕊溶液, | ___________________ | 二氧化碳和二氧化硫溶于水所得溶液都显酸性 |
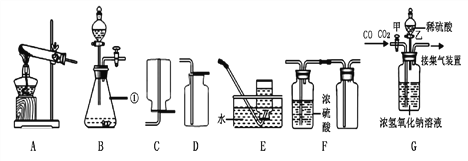
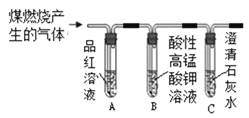
3 | 分别将二氧化碳和二氧化硫通入下列装置中
| 通过入二氧化碳时,A中无明显现象,B中_____________; 通入二氧化硫时,A中溶液由红色变成无色,B中液体变浑浊 | 二氧化硫可使品红溶液褪色,二氧化硫能使澄清石灰水变浑浊,通入二氧化碳后,B中反应的化学方程式为_______________ |
4 | 将3中通入二氧化硫后,试管A中无色液体加热 | 溶液又变成红色 | 溶液变成红色的原因是______________ |
【结论】二氧化碳和二氧化硫有一些相似的性质,但两者的性质不完全相同。
【拓展】小组同学设计如图所示装置,检验煤燃烧产物中既有二氧化碳,也有二氧化硫,实验中除可观察到B溶液变浅,但仍然有颜色外,还可观察到的现象有_________________。
【答案】 氧化物(或非金属氧化物) 二氧化碳和二氧化硫都能溶于水,且二氧化硫溶解性更好 两支试管中的溶液都变红色 溶液变浑浊 Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 不稳定的无色物质加热分解 A中溶液变成无色,C中溶液变浑浊
【解析】【理论分析】从物质分类角度,二氧化硫和二氧化碳都由两种元素组成,其中一种元素是氧元素,属于氧化物;
【设计与实验】1、两个塑料瓶都变瘪,且收集有二氧化硫的塑料瓶变得更瘪,说明二氧化碳和二氧化硫都能溶于水,且二氧化硫溶解性更好;
2、由于二氧化碳和二氧化硫溶于水所得溶液都显酸性,都可以使紫色石蕊溶液变红;
3、二氧化碳可以使使石灰水变浑浊,是因为二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为:Ca(OH)2 + CO2 = CaCO3 ↓+ H2O;
4、二氧化硫具有漂白性,其原因是二氧化硫与品红溶液等某些有色物质反应生成不稳定的无色物质,不稳定的无色物质加热分解,所以溶液又变成红色;
【拓展】二氧化硫具有漂白性,其原因是二氧化硫与品红溶液等某些有色物质反应生成不稳定的无色物质,A中溶液变成无色,通入B时,酸性高锰酸钾溶液除去二氧化碳中的二氧化硫,二氧化碳可以使使石灰水变浑浊,所以C中溶液变浑浊。

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】如图A为碳还原氧化铜的实验装置图。老师指出反应物不同的质量比可能会影响生成物的种类,在学习时,可以从定性观察和定量分析两个角度来判断生成物。请你跟随老师的思路,探究碳还原氧化铜生成的气体.(浓硫酸具有吸水性)
【提出问题】:碳还原氧化铜生成的气体是什么?
【作出猜想】:猜想①:CO 猜想②:CO2猜想③:__________
【实验设计】:装置图如图:
方案一:从定性观察角度判断:
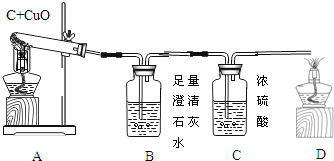
(1)若猜想3成立
Ⅰ、B处的现象是___________________
Ⅱ、D处发生反应的化学反应方程式___________________________
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
装置A | m1 | m2 |
装置B | m3 | m4 |
Ⅰ、若猜想②成立,则m4m3___m1m2(选填“>”、“<”或“=”),此时A中的现象是__________________,B发生反应的化学方程式为 _________________________
Ⅱ、实际测量中B增加的质量小于理论值,请你分析可能的原因__________________________
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是_________________
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的_______。
II.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______________;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能____________。
Ⅲ.铁的活动性探究
现用一定量的AgNO3和Cu (NO3)2混合溶液,进行了如下图所示的实验,并对溶液A和固体B的成分进行了分析和研究.
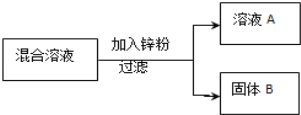
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Zn(NO3)2
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_______(填标号),其理由是__________
【实验探究】根据如表中的实验步骤及现象,完成表中的实验结论
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合猜想__, 固体B中的金属成分有________种. |
Ⅳ.生铁中铁含量的测定
某课外兴趣小组测定生铁(含杂质的铁,杂质既不溶于水也不溶于酸)中铁的质量分数,他们取五份样品,分别加稀硫酸反应.测得部分数据如下,请根据有关信息回答问题.
实验次数 | 1 | 2 | 3 | 4 | 5 |
取样品质量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸质量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
产生气体质量(g) | 0.2 | a | 0.6 | 0.8 | 0.9 |
(1)a的数值为_______________.
(2)第5次实验结束后,所得到溶液中溶质的化学式为_________________.
(3)列式计算该样品中单质铁的质量分数是______________。
(4)所用稀硫酸的溶质的质量分数为____________。