题目内容
【题目】某粗盐样品中含有少量沙土、氯化钙和氯化镁等杂质。下面是除去粗盐样品中沙土、氯化钙和氯化镁的实验流程图:
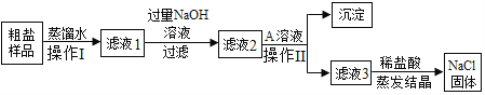
回答下列问题:
(1)操作Ⅰ名称是______________。
(2)写出杂质氯化镁和NaOH溶液反应的化学方程式:______________________________。
(3)A溶液中的溶质是__________(写化学式);稀盐酸的作用是①__________________;
②_________________________________。
(4)假设每一步反应都完全,蒸发时没有药品飞溅,那么最后得到氯化钠的质量______(填“大于”、“小于”或“等于”)粗盐样品中氯化钠的质量。
【答案】过滤 2NaOH+MgCl2=Mg(OH)2↓+2NaCl Na2CO3 除去过量的碳酸钠 除去过量的氢氧化钠 大于
【解析】
(1)操作Ⅰ是将不溶性固体和液体分离,所以名称为:过滤;
(2)氯化镁和NaOH反应生成氢氧化镁和氯化钠,方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(3)滤液2中的主要溶质为氯化钙、氢氧化钠、氯化钠,加入A溶液的目的是除去其中的氯化钙,碳酸钠与氯化钙反应会生成碳酸钙固体和氯化钠,所以A溶液的溶质为Na2CO3;
滤液3中含有氢氧化钠和碳酸钠,稀盐酸与氢氧化钠反应生成氯化钠和水,稀盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,所以加入稀盐酸的目的是除去氢氧化钠和碳酸钠;
(4)由于在除去杂质的过程中有氯化钠的生成,所以最终得到的氯化钠质量大于粗盐中氯化钠的质量。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目