题目内容
【题目】学习小组欲从高锰酸钾制氧气剩余回收副产物,设计了如图所示实验方案;
(资料卡片)①KMnO4 能和纤维素反应,在中性溶液中比较稳定,加热碱性条件中的 KMnO4 溶液会有部分KMnO4 和 H2O 反应,生成 MnO2;
②锰酸钾溶于水为墨绿色,不稳定,在水溶液中能全都转化为 KMnO4,MnO2 和 KOH,反应的化学方程式如下:3K2MnO42H2O2KMnO4MnO24KOH
(实验方案)
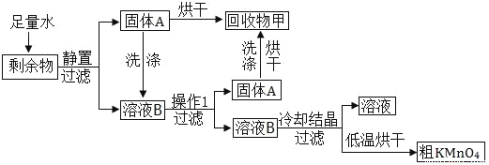
(1)将剩余物加入水中,观察到的现象是:①部分固体溶解;②有少量不溶物出现;③_______。
(2)回收物甲是_______(填化学式)。
(3)滤液B中含有KOH,需要加入少量硫酸进行中和,反应的化学方程式是_______。
(4)冷却结晶后,低温烘干高锰酸钾晶体是为了防止_______。
(5)加热 31.6gKMnO4 使之完全分解,按以上实验方案可得回收物甲的质量可能是_______。
A.8.7g B.11.5g C.12.8g D.28.4g
【答案】溶液由墨绿色变为紫红色 MnO2 H2SO4+2KOH=K2SO4+2H2O KMnO4受热分解 B
【解析】
(1)锰酸钾溶于水为墨绿色,不稳定,在水溶液中能全部转化为KMnO4、MnO2和KOH,溶液会逐渐变为紫红色,故填溶液由墨绿色变为紫红色。
(2)锰酸钾不稳定,在水溶液中能全部转化为KMnO4、MnO2和KOH,溶液显碱性,高锰酸钾在碱性环境里会转化为二氧化锰,因此回收物甲是MnO2,故填MnO2。
(3)锰酸钾不稳定,在水溶液中能全部转化为KMnO4、MnO2和KOH,溶液显碱性,高锰酸钾在碱性环境里会转化为二氧化锰,滤液B中一定含有的溶质是KMnO4和KOH,需要加入少量硫酸进行中和,中和反应是氢氧化钾和硫酸反应生成硫酸钾和水,故反应的化学方程式写为:H2SO4+2KOH=K2SO4+2H2O。
(4)冷却结晶后,低温烘干高锰酸钾晶体是为了防止KMnO4受热分解,故填KMnO4受热分解。
(5)设31.6g高锰酸钾分解生成的二氧化锰的质量为x,生成锰酸钾的质量为y,
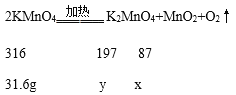
316:87=31.6g:x x=8.7g
316:197=31.6g:y y=19.7g
设生成的锰酸钾与水反应生成的二氧化锰的质量为z
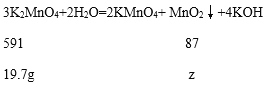
591:87=19.7g:z
z=2.9g
回收物甲(MnO2)的质量为8.7g+2.9g=11.5g,故填B。