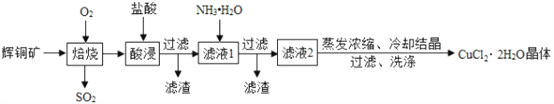
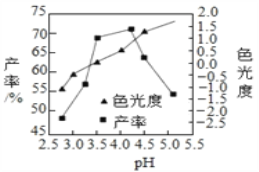
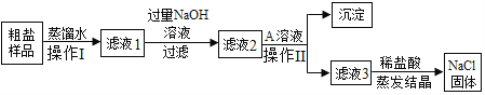
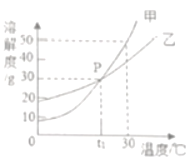
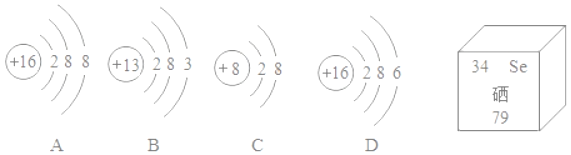题目内容
【题目】石英的主要成分为二氧化硅,它是玻璃工业和陶瓷工业的原料,冶金工业的助熔剂。
(1)二氧化硅的结构与金刚石相似,都是由________(填“分子”、“原子”、或“离子”)构成的,二氧化硅属于__________(填“酸”、“碱”、“盐”或“氧化物”)
(2)装有氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是:在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O。Na2SiO3使瓶口与瓶塞粘合在一起,则该反应的化学方程式为___________。
(3)硅是太阳电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:

①制备粗硅的反应为:SiO2+2C![]() Si+2CO↑,反应的基本类型是_____________
Si+2CO↑,反应的基本类型是_____________
②整个制备过程必须达到无水无氧,若在H2还原SiHC13过程中混入O2,可能引起的后果是_______;H2还原SiHC13的化学方程式为_________。
③为了达到绿色化学和节约资源的目的,物质往往需要循环使用,生产高纯硅的流程中,哪种物质需要循环使用______(填化学式)。
【答案】原子 氧化物 2NaOH+SiO2![]() Na2SiO3+H2O 置换反应 发生危险,引起爆炸 SiHCl3+H2
Na2SiO3+H2O 置换反应 发生危险,引起爆炸 SiHCl3+H2![]() Si+3HCl HCl
Si+3HCl HCl
【解析】
(1)金刚石是由原子构成的,故二氧化硅是由原子构成的。二氧化硅是由两种元素组成,其中一种元素是氧元素的化合物,故是氧化物。
(2)在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,该反应的方程式为:2NaOH+SiO2![]() Na2SiO3+H2O。
Na2SiO3+H2O。
(3)①该反应是由单质和化合物反应生成新的单质和新的化合物,故是置换反应。
②氢气是易燃气体,如与氧气混合,温度达到着火点,就可能引起爆炸。H2还原SiHC13生成硅和氯化氢,反应的方程式为:SiHCl3+H2![]() Si+3HCl
Si+3HCl
③由流程图可知,氯化氢气体反应前后可以循环再利用。