题目内容
【题目】某校化学兴趣小组同学,将一定量的稀硫酸滴入9.3g氢氧化钠和碳酸钠的固体混合物中,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
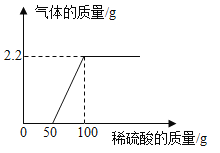
(1)产生二氧化碳气体的质量为____;
(2)混合物与稀硫酸恰好完全反应时所得溶液中溶质的质量是多少?
【答案】(1)2.2g;(2)14.2g
【解析】
(1)由图示可知产生的气体质量为2.2g,又因为稀硫酸和氢氧化钠、碳酸钠反应生成气体只有二氧化碳气体,因此产生二氧化碳气体的质量为2.2g。
(2)设50克稀硫酸中硫酸的质量为x,
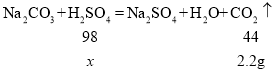
![]()
x=4.9g
恰好反应时消耗的稀硫酸的质量为100g,而100g 稀硫酸中硫酸的质量为9.8g。因为稀硫酸与氢氧化钠、碳酸钠反应后生成的溶质只有硫酸钠,
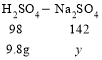
![]()
因此硫酸钠的质量y=14.2g,也就是溶质的质量为14.2g。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】过氧化钠(![]() )是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中过氧化钠药品的成分进行了如下探究。
)是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中过氧化钠药品的成分进行了如下探究。
(查阅资料)①在点燃条件下, 钠在空气中燃烧生成纯度较高的![]()
②过氧化钠能和水以及二氧化碳发生如下化学反应:
![]() ;
;
![]() .
.
③金属钠遇水会发生剧烈反应生成![]()
Ⅰ.过氧化钠的制备:
研究小组设计如图装置制备过氧化钠。
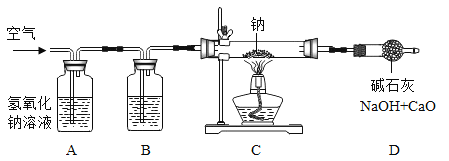
(1)装置B中的试剂是________。
(2)装置C中反应的化学方程式为________。
(3)装置D的作用是________。
Ⅱ.测定久置的过氧化钠样品的成分:
(定性检测)检测样品的成分
(4)请补充完成下列实验报告中的相关内容。
实验序号 | 实验步骤 | 实验现象 | 解释或结论 |
① | 取少量固体样品于试管中,加入适量的水 | 样品全部溶解,无气泡产生 | 样品中不含__; |
② | 取适量①中的溶液于试管中,加入过量的 | 有白色沉淀产生 | 化学方程式为_; |
③ | 待②充分静置后,向上层清液中滴入________; | _____; | 含有氢氧化钠 |
(定量检测)检测药品的组成。
(5)实验④:称取10g上述过氧化钠样品于试管中,加入足量的稀硫酸,将产生的气体全部鼓入到足量的澄清石灰水中,过滤、洗涤、干燥,得到碳酸钙固体5.00g。计算确定样品中氢氧化钠的质量分数_______(写出计算过程)
【题目】某密闭容器中有X、O2和NO三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表.根据表中信息,判断下列说法正确的是
物质 | X | O2 | NO | H2O |
反应前质量/g | 17 | 70 | 1 | 0 |
反应后质量/g | 0 | 待测 | 31 | 27 |
A.该反应为置换反应
B.X的化学式可能是NH3
C.表中“待测”值为36
D.反应生成的NO和H2O的个数比为3∶2
【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于氟元素的一条信息:_________。
(2) 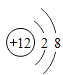 写出该结构简图的微粒符号_______。
写出该结构简图的微粒符号_______。
(3)第13号元素与第17号元素组成的化合物的化学式是 _______。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是____________(填字母序号)。
A Be和Mg
B C和Ne
C Al和Si
D F和Cl
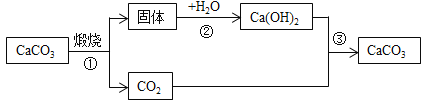
【题目】碳酸钠俗称纯碱或苏打,在生活、生产和实验硏究中均有广泛应用。
(配制溶液)配制溶质质量分数分別为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是______(填字母)。
a.用托盘天平称取2gNa2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ |
溶质质量分数 | 1% | 2% | 4% |
溶液pH | 11.62 | 11.76 | 11.90 |
分析I、Ⅱ、Ⅲ三组数据可得出的结论是________。
(制备物质)用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
(已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀)
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是______(填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:![]() ,则X的化学式为___________。
,则X的化学式为___________。
(标定浓度)标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于1g·mL-1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数_____(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将_____(填“偏大”、“偏小”或“无影响”)。