题目内容
【题目】兴趣小组的同学们在老师的指导下进行实验室制取氧气的实验。
(1)甲同学称取一定质量的高锰酸钾固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的氧气大于理论产量。针对这一现象,进行了如下探究:
[提出猜想]猜想I:反应生成的二氧化锰分解放出氧气;猜想II:反应生成的锰酸钾分解放出氧气;猜想III:_________________
[实验验证]同学们分成两组,分别进行下列实验:第一组同学取一定质量的二氧化锰,在250℃条件下加热一段时间,冷却后测得二氧化锰的质量不变,则猜想______错误;第二组同学取锰酸钾在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择的实验方法是______________。
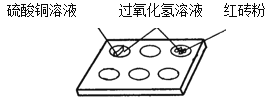
(2)白色点滴板是带有空穴的白色瓷板,可用作微型化学反应。在寻找新催化剂时,将一定量的红砖粉、硫酸铜溶液……分别加入点滴板中,再分别滴入过氧化氢溶液(如图所示),观察到过氧化氢溶液产生气泡的速率加快。据此现象得出结论:红砖粉、硫酸铜溶液等也能做过氧化氢溶液的催化剂。小红认为不正确,
理由一:未探究它们的质量在反应前后是否不变;
理由二:_______________________。
白色点滴板作为反应容器的优点有______________________
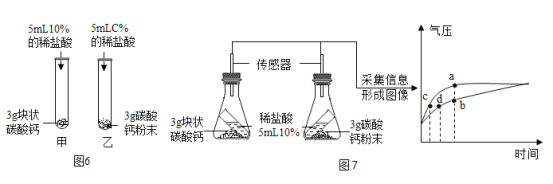
(3)通过对催化剂的实验探究,同学们还想探究影响反应速率的其他因素。于是在老师的指导下查阅资料,资料表明:影响反应速率的其他因素还有温度,浓度,物质的纯度和固体的形状大小等。根据查阅的资料同学们设计了实验室用锌与稀硫酸反应制取氢气的实验。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
验实号编 | 试剂 | 前 10 min 内产生的氢气体积(mL) | |
不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
a | 纯锌 | 30 mL 30 % | 564.3 |
b | 含杂质的锌 | 30 mL 30 % | 634.7 |
c | 纯锌 | 30 mL 20 % | 449.3 |
d | 纯锌 | 40 mL 30 % | 602.8 |
① 比较实验 a 和实验 b ,可以得到的结论是________________________。
② 为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③ 控制其他条件相同,需控制的条件是__________________(例举一种条件即可)。
通过实验,同学们明白了一个道理,物质的纯度对化学反应速率有很大影响,但是不一定是纯度越大反应速率越快,有时候也会有一些特殊情况。
【答案】二氧化锰和氯酸钾加热都能生成氧气Ⅰ将带火星的木条放入试管中未探究它们的化学性质在化学反应前后不变节约药品与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速度要快ac温度或锌粒形状大小等
【解析】
(1)[提出猜想]猜想III:可以是二氧化锰和氯酸钾加热都能生成氧气;
[实验验证]第一组同学取一定质量的二氧化锰,在250℃条件下加热一段时间,冷却后测得二氧化锰的质量不变,说明二氧化锰不能生成氧气,则猜想Ⅰ错误;第二组同学取锰酸钾在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论,采用的实验方法是将带火星的木条放入试管中;
(2)催化剂在化学反应前后的质量和化学性质都不变,故小红认为不正确,是因为未探究它们的化学性质在化学反应前后不变;白色点滴板作为反应容器,可以节约药品;
(3)①比较实验a和实验b,可以看出,与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速度要快;
②为了研究硫酸浓度对反应快慢的影响,可以比较实验a和实验c;
③控制其他条件相同,需要控制温度或锌粒形状大小等。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】某兴趣小组做了如下实验.
(实验一)提纯 NaCl
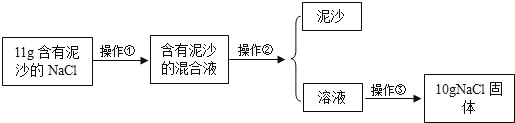
请根据实验回答下列问题:
(1)操作①、②、③依次为图中的(填序号)______.
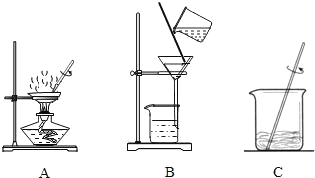
(2)若得到 NaCl 的产率比实际值偏低,则可能的原因是(填序号)_______.
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.把晶体从蒸发皿转移到天平上称量时,有少量粘在了蒸发皿上
D.溶解 11g 含有泥沙的 NaCl 时,加入的水量不足
(3)用上述实验所得的氯化钠配制溶质质量分数为 5%的氯化钠溶液 50g,不需 要的仪器为(填序号)_____.
A.量筒 B.天平 C.烧杯 D.漏斗 E.蒸发皿 F.玻璃棒 G.酒 精灯
(实验二)溶解和结晶 KNO3
请根据实验和 KNO3 溶解度曲线回答下列问题(水的密度以 1g/mL 计):
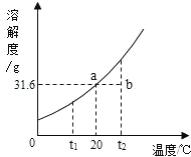
实验操作 | 实验结果 |
取 100mL 水,加入 25g KNO3,搅拌,20℃ | 全部溶解,得溶液① |
再加 Xg KNO3,搅拌,20℃ | 恰好饱和,得溶液② |
再加 25g KNO3,搅拌,20℃ | 得溶液③ |
加热 | 全部溶解,得溶液④ |
冷却至 20℃ | 晶体析出,得溶液⑤ |
(4)溶液③的质量为_____;一定属于不饱和溶液的是(填数字序号)_____; 溶质的质量分数一定相等的是(填序号)_____.
(5)析出晶体的质量为(填序号)_____.
A.25g B.X+25g C.X+100g.
【题目】化学反应之间、化学物质之间具有包含、并列、交叉等关系。下表中X、Y符合下图所示关系的是( )
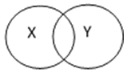
A | B | C | D | |
X | 化合反应 | 化合反应 | 纯净物 | 燃烧 |
Y | 氧化反应 | 分解反应 | 混合物 | 氧化反应 |
A. A B. B C. C D. D
【题目】某化学兴趣小组同学在回收废旧电池的同时,开展了如下的实验探究。
(查阅资料)废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。
(实验1)废干电池的拆卸与处理
(1)兴趣小组同学将废旧干电池卸下的锌筒、碳棒冲洗干净,备用。
(2)将铜帽放入盐酸中,除去锈污,冲洗备用。
(实验2)检验废干电池筒内黑色固体中的二氧化锰存在
兴趣小组同学设计了如下图所示的实验:
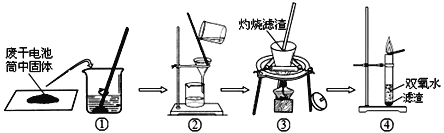
(1)操作③灼烧黑色滤渣时,会产生一种气体能使澄清石灰水变浑浊,灼烧时的表达式为____;澄清石灰水变浑浊的表达式为____。
(2)操作④试管中产生的气体能使带火星木条复燃,该气体为__________。
(3)由此得出结论:滤渣中黑色固体化学式为_____和 _____
(实验3)利用回收锌皮制取氢气及相关探究
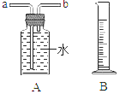
(1)用锌皮和稀硫酸制取氢气。用适当的发生装置,采用排水法收集并测定氢气的体积(如右图),气体从装置A导管口___(填“ a ”或“ b ” ) 进,选用仪器B测量排出水的体积,仪器B名称是______。
(2)探究影响锌与稀硫酸反应快慢的因素。反应过程中用前10 min 内
收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表4组实验,获得数据如下。
实验编号 | 试剂 | 前10 min内产生的 氢气体积(mL) | |
锌的纯度 | 稀硫酸的体积和浓度 | ||
a | 纯锌 | 30 mL 30 % | 564.3 |
b | 含杂质的锌 | 30 mL 30 % | 634.7 |
c | 纯锌 | 30 mL 20 % | 449.3 |
d | 纯锌 | 40 mL 30 % | 602.8 |
[数据分析]
①比较实验a和实验b得到的结论是:_________________________。
②为了研究硫酸浓度对反应快慢的影响,需比较实验____________(填实验编号)。
③探究影响该反应快慢的因素,还需控制的条件是:______________(一例即可)。
(实验4)探究经处理干净的二氧化锰在氯酸钾分解反应中的催化作用(已知氯化钾可溶)
(1)把干燥纯净的24.5g氯酸钾和5.5g二氧化锰混匀、装入大试管中,加热。
(2)待反应完全后,将试管冷却、称量,得到20.4g残留固体。
(3)再将残留固体经溶解、_____、洗涤、干燥、称量,得到5.5g黑色固体。
[数据分析]
①该实验说明:二氧化锰在氯酸钾分解反应前后,_____不变。
②完全反应后制得氧气的质量是______g。(提示:已知所有化学反应遵循如下规律:参加化学反应的各物质的质量总和等于反应后生成各生成物的质量总和)
[实验反思]
要证明二氧化锰是氯酸钾分解反应的催化剂,还要做一个对比实验:将等质量的2份氯酸钾粉末,其中一份加入少量的上述实验所得二氧化锰混匀、装入试管,另一份装入另一试管,加热,比较____________的大小。