题目内容
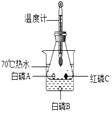
【题目】某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了13.6g固体样品,用下图所示的装置继续实验,完全反应后,测定的有关数据如下表所示。
A中固体 的质量 | 澄清石灰水 的质量 | |
反应前 | 13.6g | 102.5g |
反应后 | 11.2g | 108.0g |
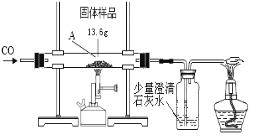
请计算:
⑴实验中先通CO的目的是____________________________________。
⑵从上表中选择合适的数据,计算固体样品中氧化铁的质量是_____________克。
⑶在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数___。(请写出完整计算过程,结果精确到0.1%)
【答案】 除去装置内的空气,防止加热时引起爆炸 8 22.9%
【解析】(1)由于一氧化碳具有可燃性,不纯点燃可能引起爆炸,所以实验中先通CO,除去装置内的空气;
(2)因为少量澄清石灰水不能将生成的二氧化碳完全吸收,所以应该选择A中固体的质量变化进行计算,固体减少的质量为13.6g-11.2g=2.4g,即为氧化铁中氧元素的质量,
设氧化铁的质量为x,
Fe2O3+3CO ![]() 2Fe+3CO2 固体减重
2Fe+3CO2 固体减重
160 112 160-112=48
y (13.6g-11.2 g)=2.4g
![]()
解得x=8g
⑶设生成的FeCl2和H2质量分别为y、z,
Fe + 2HCl =FeCl2 + H2↑
56 127 2
11.2g y z
![]()
解得y=25.4g ,z=0.4g
则反应后的溶液中溶质的质量分数为![]() ×100%≈22.9%。
×100%≈22.9%。
答:反应后的溶液中溶质的质量分数为22.9%。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】某化工厂排出的废水溶质可能由硫酸钠、碳酸钠、氯化钠、氢氧化钠中的一种或多种组成,为确认其组成,某化学实验小组进行了如下两组实验。
实验一 | 实验二 | ||||
步骤 | 试剂 | 现象 | 步骤 | 试剂 | 现象 |
① | 取少量废水于烧杯 | / | ① | 取少量废水于烧杯 | / |
② | 滴入少量酚酞 | —— | ② | 滴入过量 | 产生沉淀 |
③ | 继续滴加过量稀盐酸 | 产生气体 | ③ | 过滤得滤液和滤渣 | / |
④ | 继续滴加少量 | 产生沉淀 | ④ | 向滤液中滴入少量酚酞 | 无明显现象 |
⑤ | 过滤取滤液 | / | ⑤ | 继续滴少量 | 产生沉淀 |
⑥ | 向滤液中滴少量 | 无沉淀 | ⑥ | 向滤渣中滴过量稀盐酸 | 沉淀消失 |
根据上述两组实验及其现象,回答下列问题:
(1)实验一步骤②所对应的现象为_____________________________________。
(2)实验一步骤③产生气体的反应的化学方程式为________________________
(3)废水中一定无_________(填化学式,下同),可能有_________________
(4)媛媛为进一步确认废水组成,另取废水进行定量实验,测得其中阳离子与阴离子的个数比约为4:3,由此可知原废水溶质为______________。
(5)实验二为相同实验目的,酚酞可用下列试剂_____(填序号)中任意一种替换。
A.铁粉 B.硝酸铜溶液 C.紫色石蕊 D.稀硝酸