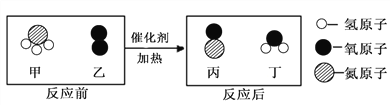
题目内容
【题目】某化工厂排出的废水溶质可能由硫酸钠、碳酸钠、氯化钠、氢氧化钠中的一种或多种组成,为确认其组成,某化学实验小组进行了如下两组实验。
实验一 | 实验二 | ||||
步骤 | 试剂 | 现象 | 步骤 | 试剂 | 现象 |
① | 取少量废水于烧杯 | / | ① | 取少量废水于烧杯 | / |
② | 滴入少量酚酞 | —— | ② | 滴入过量 | 产生沉淀 |
③ | 继续滴加过量稀盐酸 | 产生气体 | ③ | 过滤得滤液和滤渣 | / |
④ | 继续滴加少量 | 产生沉淀 | ④ | 向滤液中滴入少量酚酞 | 无明显现象 |
⑤ | 过滤取滤液 | / | ⑤ | 继续滴少量 | 产生沉淀 |
⑥ | 向滤液中滴少量 | 无沉淀 | ⑥ | 向滤渣中滴过量稀盐酸 | 沉淀消失 |
根据上述两组实验及其现象,回答下列问题:
(1)实验一步骤②所对应的现象为_____________________________________。
(2)实验一步骤③产生气体的反应的化学方程式为________________________
(3)废水中一定无_________(填化学式,下同),可能有_________________
(4)媛媛为进一步确认废水组成,另取废水进行定量实验,测得其中阳离子与阴离子的个数比约为4:3,由此可知原废水溶质为______________。
(5)实验二为相同实验目的,酚酞可用下列试剂_____(填序号)中任意一种替换。
A.铁粉 B.硝酸铜溶液 C.紫色石蕊 D.稀硝酸
【答案】 液体由无色变为红色 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ NaOH和Na2SO4 NaCl Na2CO3 和NaCl BC
【解析】(1)根据滴加过量稀盐酸,产生气体,可确定废水中含有Na2CO3,Na2CO3溶液显碱性,能使酚酞溶液变红,所以实验一步骤②所对应的现象为液体由无色变为红色。(2)在液体中生成气体冒气泡。Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑(3))实验二中,滴入过量![]() 溶液,产生白色沉淀,向滤液中滴入少量酚酞,无明显现象,说明废水中一定无NaOH,向滤渣中滴过量稀盐酸,沉淀消失,说明含有Na2CO3 ,无Na2SO4、NaOH,可能含有NaCl。(4)Na2CO3 电离出的Na+、CO32-个数比约为2:1,即阳离子与阴离子的个数比为2:1,NaCl电离出的Na+、Cl-个数比为1:1,当Na2CO3与NaCl个数比为1:2时,阳离子与阴离子的个数比约为4:3,所以由此可知原废水溶质为Na2CO3与NaCl。(5)实验二中,加入酚酞试液的目的是检验NaOH是否存在。A. 铁粉与NaOH不反应,无现象,错误;B. 2NaOH + Cu(NO3)2 == Cu(OH)2↓+ 2NaNO3,出现蓝色沉淀,说明NaOH存在,正确;C. 紫色石蕊溶液遇NaOH溶液变蓝,溶液变蓝,说明NaOH存在,正确;D. 稀硝酸与NaOH反应,无现象,错误。故选BC。
溶液,产生白色沉淀,向滤液中滴入少量酚酞,无明显现象,说明废水中一定无NaOH,向滤渣中滴过量稀盐酸,沉淀消失,说明含有Na2CO3 ,无Na2SO4、NaOH,可能含有NaCl。(4)Na2CO3 电离出的Na+、CO32-个数比约为2:1,即阳离子与阴离子的个数比为2:1,NaCl电离出的Na+、Cl-个数比为1:1,当Na2CO3与NaCl个数比为1:2时,阳离子与阴离子的个数比约为4:3,所以由此可知原废水溶质为Na2CO3与NaCl。(5)实验二中,加入酚酞试液的目的是检验NaOH是否存在。A. 铁粉与NaOH不反应,无现象,错误;B. 2NaOH + Cu(NO3)2 == Cu(OH)2↓+ 2NaNO3,出现蓝色沉淀,说明NaOH存在,正确;C. 紫色石蕊溶液遇NaOH溶液变蓝,溶液变蓝,说明NaOH存在,正确;D. 稀硝酸与NaOH反应,无现象,错误。故选BC。

【题目】某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了13.6g固体样品,用下图所示的装置继续实验,完全反应后,测定的有关数据如下表所示。
A中固体 的质量 | 澄清石灰水 的质量 | |
反应前 | 13.6g | 102.5g |
反应后 | 11.2g | 108.0g |
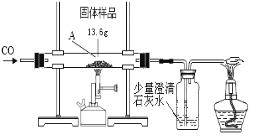
请计算:
⑴实验中先通CO的目的是____________________________________。
⑵从上表中选择合适的数据,计算固体样品中氧化铁的质量是_____________克。
⑶在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数___。(请写出完整计算过程,结果精确到0.1%)
【题目】某化学兴趣小组的同学利用下图装置制取并收集一瓶二氧化碳气体,请和他们一起完成以下实验探究。
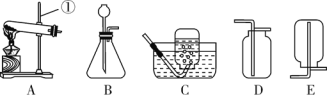
(1)写出标号①的仪器名称________。
(2)实验室制取一瓶二氧化碳气体,应选用的收集装置为________(填序号),反应的化学方程式为____________________。
(3)化学兴趣小组的同学对反应后废液中溶质的成分进行进一步探究。
(提出问题)废液中的溶质有哪些物质?
(查阅资料)氯化钙溶液呈中性。
(猜想与假设)猜想①:废液中的溶质只有氯化钙;
猜想②:废液中的溶质是氯化钙和________(填化学式)。
(设计并进行实验)Ⅰ. 为验证上面两种猜想哪种正确,甲小组的同学从下面A~E五种药品中选择合适的一种进行实验,证明了猜想②是正确的。他们选择的药品不可能是________。
A. 紫色石蕊试液 B. 无色酚酞试液 C. 锌粒 D. 氧化铁粉末 E. 氢氧化钠溶液
Ⅱ. 乙小组选用一种钠盐溶液进行实验,也证明了猜想②是正确的,请完成下面的实验报告。
实验操作 | 实验现象 | 实验结论 |
取少量反应后的废液于试管中,加入足量___________(填化学式)溶液,振荡 | _______________ | 猜想②正确 |
(探究反思):实验产生的污染深受人们重视,我们要利用恰当的方法对废液进行处理,实行无害化排放,从源头上消除对环境的污染。
(4)使用纯碱中常含有少量的氯化钠,现取某使用纯碱样品2.5g,加水溶解,配成溶液,向其中加入一定量CaCl2溶液恰好完全反应,同时产生了2g沉淀。试计算该食用纯碱中Na2CO3的质量分数_____________(写出计算过程)。