题目内容
某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.探究l:研究常见的物质---氢氧化钠和盐酸的反应程度.
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入 固体化台物______. | ______ | 盐酸过量 |
通过探究实验,同学们发现硫酸和盐酸溶液都可以和锌反应产生氢气.产生这种共同现象的原因为______
探究3:探索未知---浓硝酸和铜制取气体.
已知Cu+4HN03(浓)=Cu( NO3)2+H2O+2N02↑.N02能和水反应生成硝酸和N0.NO和NO2都是空气的污染物.
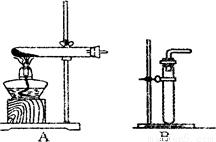
(1)利用该反应制取二氧化氮的发生装置,应选用图所示装置中的______.收集N02的方法为______.
(2)反应NO+X→N02中,X的化学式应为______;若用浓硝酸和铜制取NO,应采用的收集方法是______.
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入l0g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009.8g,请你计算所加碳酸钠溶液的溶质质量分数?
【答案】分析:探究一:根据酸的化学性质分析;
探究二:根据酸的定义及特征分析;
探究三:根据反应物的状态和反应条件选择发生装置,根据溶解性和密度选择收集方法.
探究四:根据化学方程式的计算分析.
解答:解:探究一:因盐酸能与碳酸盐反应产生气泡的明显现象,可以用来检验盐酸,故答案为:Na2CO3(或CaCO3),有气泡产生.
探究二:酸的共同特征是电离出的阳离子都是氢离子,决定了酸具有相似的化学性质.故答案为:硫酸和盐酸溶液中都含有氢离子.
探究三:(1)制取二氧化氮的反应物状态和反应条件属于固液、常温型,故选B;有因为二氧化氮易与水反应,故不能用排水法收集,根据相对分子质量法比较:46>29可知二氧化氮的密度大于空气,故采用向上排空气法收集.
(2)化学反应前后元素的种类不变,故反应物为氧气;因为浓硝酸和铜反应先生成二氧化氮,再由二氧化氮和水反应生成一氧化氮,同时说明一氧化氮难溶于水,故采用排水法收集.
探究四:根据反应前后的质量差可知,生成CaCO3沉淀的质量为1000g+10g-1009.8g=0.2g
设:反应物中Na2CO3的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 0.2g
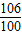 =
=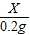
x=0.212g
碳酸钠溶液溶质质量分数为:0.212g/10g×100%=2.12%
答:所加碳酸钠溶液的溶质质量分数为2.12%.
答案为:故探究1:(2分)Na2CO3(或CaCO3),有气泡产生.
探究2:硫酸和盐酸溶液中都含有氢离子
探究3:(1)B 向上排空气法 (2)O2 排水法
探究4:解:根据反应前后的质量差可知,生成CaCO3沉淀的质量为1000+10-1009.8=0.2g
设:反应物中Na2CO3的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 0.2g
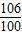 =
=
x=0.212g
碳酸钠溶液溶质质量分数为:0.212g/10g×100%=2.12%
答:所加碳酸钠溶液的溶质质量分数为2.12%.
点评:此题考查的内容较多,要逐一分析解答.
探究二:根据酸的定义及特征分析;
探究三:根据反应物的状态和反应条件选择发生装置,根据溶解性和密度选择收集方法.
探究四:根据化学方程式的计算分析.
解答:解:探究一:因盐酸能与碳酸盐反应产生气泡的明显现象,可以用来检验盐酸,故答案为:Na2CO3(或CaCO3),有气泡产生.
探究二:酸的共同特征是电离出的阳离子都是氢离子,决定了酸具有相似的化学性质.故答案为:硫酸和盐酸溶液中都含有氢离子.
探究三:(1)制取二氧化氮的反应物状态和反应条件属于固液、常温型,故选B;有因为二氧化氮易与水反应,故不能用排水法收集,根据相对分子质量法比较:46>29可知二氧化氮的密度大于空气,故采用向上排空气法收集.
(2)化学反应前后元素的种类不变,故反应物为氧气;因为浓硝酸和铜反应先生成二氧化氮,再由二氧化氮和水反应生成一氧化氮,同时说明一氧化氮难溶于水,故采用排水法收集.
探究四:根据反应前后的质量差可知,生成CaCO3沉淀的质量为1000g+10g-1009.8g=0.2g
设:反应物中Na2CO3的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 0.2g
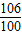 =
=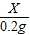
x=0.212g
碳酸钠溶液溶质质量分数为:0.212g/10g×100%=2.12%
答:所加碳酸钠溶液的溶质质量分数为2.12%.
答案为:故探究1:(2分)Na2CO3(或CaCO3),有气泡产生.
探究2:硫酸和盐酸溶液中都含有氢离子
探究3:(1)B 向上排空气法 (2)O2 排水法
探究4:解:根据反应前后的质量差可知,生成CaCO3沉淀的质量为1000+10-1009.8=0.2g
设:反应物中Na2CO3的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 0.2g
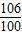 =
=
x=0.212g
碳酸钠溶液溶质质量分数为:0.212g/10g×100%=2.12%
答:所加碳酸钠溶液的溶质质量分数为2.12%.
点评:此题考查的内容较多,要逐一分析解答.

练习册系列答案
相关题目
某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动。探究l:研究常见的物质一一氢氧化钠和盐酸的反应程度。
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入 固体化台物________。 | | 盐酸过量 |
通过探究实验,同学们发现硫酸和盐酸溶液都可以和锌反应产生氢气。产生这种共同现象的原因为
探究3:探索未知一一浓硝酸和铜制取气体。
已知Cu十4HN03(浓)="Cu(" NO3)2+H2O+2N02↑。N02能和水反应生成硝酸和N0。NO和NO2都是空气的污染物。
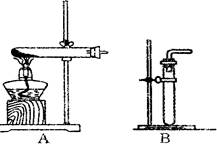
(1)利用该反应制取二氧化氮的发生装置,应选用图所示装置中的_______。收集N02的方法为________ 。
(2)反应NO+X→N02中,X的化学式应为____;若用浓硝酸和铜制取NO,应采用的收集方法是____
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入l0g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009. 8g,请你计算所加碳酸钠溶液的溶质质量分数?
某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动。探究l:研究常见的物质一一氢氧化钠和盐酸的反应程度。
|
实验内容 |
实验现象 |
解释与结论 |
|
取反应后少量溶液于试管中,加入 固体化台物________。 |
|
盐酸过量
|
探究2:研究酸的性质----硫酸、盐酸和锌反应
通过探究实验,同学们发现硫酸和盐酸溶液都可以和锌反应产生氢气。产生这种共同现象的原因为
探究3:探索未知一一浓硝酸和铜制取气体。
已知Cu十4HN03(浓)=Cu( NO3)2+H2O+2N02↑ 。N02能和水反应生成硝酸和N0。NO和NO2都是空气的污染物。
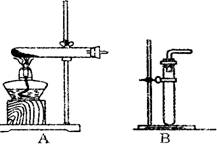
(1)利用该反应制取二氧化氮的发生装置,应选用图所示装置中的_______。收集N02的方法为________ 。
(2)反应NO+X→N02中,X的化学式应为____;若用浓硝酸和铜制取NO,应采用的收集方法是____
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入l0g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009. 8g,请你计算所加碳酸钠溶液的溶质质量分数?
 (2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
(2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.