题目内容
某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动。探究l:研究常见的物质一一氢氧化钠和盐酸的反应程度。
|
实验内容 |
实验现象 |
解释与结论 |
|
取反应后少量溶液于试管中,加入 固体化台物________。 |
|
盐酸过量
|
探究2:研究酸的性质----硫酸、盐酸和锌反应
通过探究实验,同学们发现硫酸和盐酸溶液都可以和锌反应产生氢气。产生这种共同现象的原因为
探究3:探索未知一一浓硝酸和铜制取气体。
已知Cu十4HN03(浓)=Cu( NO3)2+H2O+2N02↑ 。N02能和水反应生成硝酸和N0。NO和NO2都是空气的污染物。
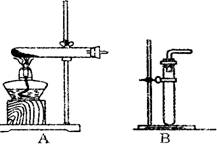
(1)利用该反应制取二氧化氮的发生装置,应选用图所示装置中的_______。收集N02的方法为________ 。
(2)反应NO+X→N02中,X的化学式应为____;若用浓硝酸和铜制取NO,应采用的收集方法是____
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入l0g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009. 8g,请你计算所加碳酸钠溶液的溶质质量分数?
.探究1:(2分)Na2CO3(或CaCO3),有气泡产生。
探究2:(1分)硫酸和盐酸溶液中都含有氢离子
探究3:(4分)(1)B 向上排空气法 (2)O2 排水法
探究4:(3分)2.12%
【解析】根据盐酸和碳酸盐生成二氧化碳气体, 酸溶液中都含有氢离子,根据反应需不需要加热,以及N02的性质进行解答
由题意可知碳酸钙的质量=1000+10-1009.8=0.2g根据化学方程式列比例式求得碳酸钠的质量进行解答
探究4:解:生成CaCO3沉淀的质量为1000+10-1009.8=0.2g………………………(1分)
设:反应物中Na2CO3的质量为x
Na2CO3+Ca(OH)2 == CaCO3↓+2NaOH
106 100
x 0.2g
106/100=x/0.2
x =0.212g………………………………………………………… (1分)
碳酸钠溶液溶质质量分数为:(0.212÷10)×100%=2.12%………………(1分)
答:所加碳酸钠溶液的溶质质量分数为2.12%。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动。探究l:研究常见的物质一一氢氧化钠和盐酸的反应程度。
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入 固体化台物________。 | | 盐酸过量 |
通过探究实验,同学们发现硫酸和盐酸溶液都可以和锌反应产生氢气。产生这种共同现象的原因为
探究3:探索未知一一浓硝酸和铜制取气体。
已知Cu十4HN03(浓)="Cu(" NO3)2+H2O+2N02↑。N02能和水反应生成硝酸和N0。NO和NO2都是空气的污染物。
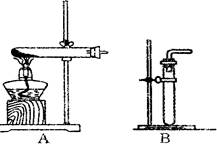
(1)利用该反应制取二氧化氮的发生装置,应选用图所示装置中的_______。收集N02的方法为________ 。
(2)反应NO+X→N02中,X的化学式应为____;若用浓硝酸和铜制取NO,应采用的收集方法是____
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入l0g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009. 8g,请你计算所加碳酸钠溶液的溶质质量分数?
探究l:研究常见的物质---氢氧化钠和盐酸的反应程度.
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入 固体化台物______. | ______ | 盐酸过量 |
通过探究实验,同学们发现硫酸和盐酸溶液都可以和锌反应产生氢气.产生这种共同现象的原因为______
探究3:探索未知---浓硝酸和铜制取气体.
已知Cu+4HN03(浓)=Cu( NO3)2+H2O+2N02↑.N02能和水反应生成硝酸和N0.NO和NO2都是空气的污染物.
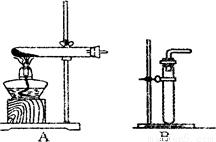
(1)利用该反应制取二氧化氮的发生装置,应选用图所示装置中的______.收集N02的方法为______.
(2)反应NO+X→N02中,X的化学式应为______;若用浓硝酸和铜制取NO,应采用的收集方法是______.
探究4:兴趣小组同学向盛有澄清石灰水1000g的大烧杯中加入l0g碳酸钠溶液,恰好完全反应后过滤去沉淀,剩余液体总质量为1009.8g,请你计算所加碳酸钠溶液的溶质质量分数?
 (2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
(2013?许昌一模)某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.