题目内容
某同学利用日常生活中常见的用品制作了一套如图所示的装置,用该装置对粗锌样品进行实验.请帮助完成下列实验报告.
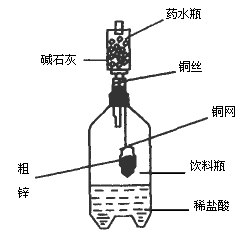
(一)实验目的:测定________.
(二)实验用品:托盘天平、药水瓶、铜网、铜丝、饮料瓶.粗锌、稀盐酸、碱石灰(CaO和NaOH).
(三)实验步骤
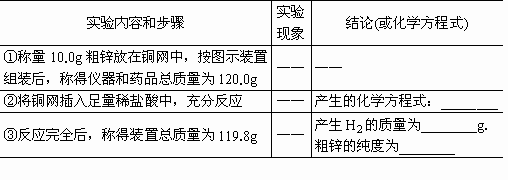
(四)问题探究:(说明:不考虑空气中CO2和H2O对实验的影响)
1 该实验中碱石灰的作用是________,若去掉碱石灰,则所测定的粗锌纯度________(填“偏大”、“偏小”或“无影响”.)
2 若只将粗锌换成石灰石,原实验方案能否用于石灰石样品纯度的测定?________.(填“能”或“不能”),理由是________.
3 若将图中药水瓶改成直导管、粗锌换成纯锌,用原方案测定锌的相对原子质量结果________.(填“偏大”、“偏小”或“无影响”)
答案:
解析:
解析:
|
(一)样品中锌的质量分数 (三)Zn+2HCl=ZnCl2+H2↑,0.2,65% (四)1干燥氢气,偏大;2不能,碱石灰能与二氧化碳反应,无法知道二氧化碳的质量;3偏小 |

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
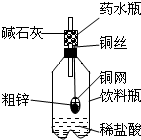 某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请帮助完成下列实验报告
某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请帮助完成下列实验报告(1)实验目的:测定
(2)实验用品:托盘天平、药水瓶、铜网、铜丝、饮料瓶、粗锌、稀盐酸、碱石灰(CaO与Na0H的混合物).
(3)实验步骤:
| 实验内容和步骤 | 实验现象 | 结论(或化学方程式) |
| ①称量10.0g粗锌放在铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g | ||
| ②将铜网插入足量稀盐酸中,充分反应 | 发生的化学方程式: | |
| ③反应完全后,称得装置总质量为119.8g | 产生H2的质量为 粗锌的纯度为 |
①该实验中碱石灰的作用是
②若只将粗锌换成石灰石,原实验方案能否用于石灰石样品纯度的测定
③若将图中药水瓶改成直导管、粗锌换成纯锌,用原方案测定锌的相对原子质量,则结果
 某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请帮助完成下列实验报告
某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请帮助完成下列实验报告
(1)实验目的:测定______.
(2)实验用品:托盘天平、药水瓶、铜网、铜丝、饮料瓶、粗锌、稀盐酸、碱石灰(CaO与Na0H的混合物).
(3)实验步骤:
| 实验内容和步骤 | 实验现象 | 结论(或化学方程式) |
| ①称量10.0g粗锌放在铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g | ||
| ②将铜网插入足量稀盐酸中,充分反应 | 发生的化学方程式: | |
| ③反应完全后,称得装置总质量为119.8g | 产生H2的质量为______g. 粗锌的纯度为______ |
①该实验中碱石灰的作用是______,若去掉碱石灰,则所测定的粗锌纯度______(填“偏大”、“偏小”、“无影响”).
②若只将粗锌换成石灰石,原实验方案能否用于石灰石样品纯度的测定______(填“能”或“不能”),理由是______.
③若将图中药水瓶改成直导管、粗锌换成纯锌,用原方案测定锌的相对原子质量,则结果______.(填“偏大”、“偏小”、“无影响”)
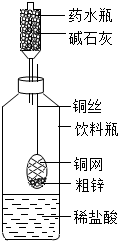 某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请你帮助完成下列实验报告.
某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请你帮助完成下列实验报告. 某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请帮助完成下列实验报告.
某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请帮助完成下列实验报告. 某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请你帮助完成下列实验报告.
某同学利用日常生活中常见的用品制作了一套如图装置,用该装置对粗锌样品进行实验.请你帮助完成下列实验报告.