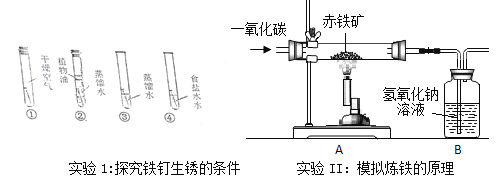
题目内容
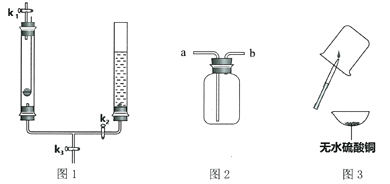
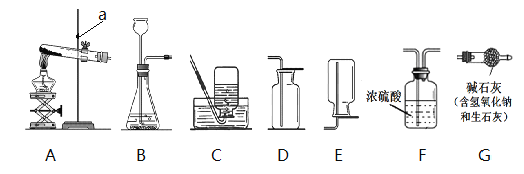
【题目】某兴趣小组同学称取10g氧化铜和碳粉,通过下列实验对其中炭粉含量进行探究。实验前进行知识准备:2Cu + O2 ![]() 2CuO
2CuO

(1)关闭弹簧夹,打开分液漏斗活塞。写出A中的化学反应方程式________________________________。
(2)点燃酒精灯,将尖嘴管对着火焰,以提高温度,其原因是________________________________。玻璃管中发生的反应为 木炭还原氧化铜:C+ 2CuO → 2Cu + CO2↑,该反应条件是__________。
(3)反应一段时间,装置B中一定会观察到_____________________。装置D中澄清石灰水不变浑浊,说明__________________________________________。
(4)再打开弹簧夹,继续加热装置B,装置C中观察到的现象是____________________。
直至固体颜色不再变化后停止加热,称量装置C,质量比反应前增重4.4g,增重质量就是____________质量。通过计算可知装置B中含碳元素质量为____________g。本实验还可以通过称量____________________,也能计算出原混合物中碳的质量分数。
【答案】 2H2O2![]() O2↑+ 2H2O 氧气具有助燃性(或氧气使酒精燃烧更充分) 高温 黑色固体变成红色 CO2被NaOH完全吸收 有气泡冒出 生成的CO2 1.2 B中玻璃管及其中固体在反应前后的总质量
O2↑+ 2H2O 氧气具有助燃性(或氧气使酒精燃烧更充分) 高温 黑色固体变成红色 CO2被NaOH完全吸收 有气泡冒出 生成的CO2 1.2 B中玻璃管及其中固体在反应前后的总质量
【解析】(1)过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,反应方程式为2H2O2![]() O2↑+ 2H2O
O2↑+ 2H2O
(2)尖嘴管中放出的是氧气,氧气具有助燃性(或氧气使酒精燃烧更充分),提供更高的温度;木炭还原氧化铜的条件是高温;
(3)反应一段时间,装置B中黑色固体变成红色;装置D中澄清石灰水不变浑浊,说明CO2被NaOH完全吸收;
(4)再打开弹簧夹,继续加热装置B,装置C中观察到的现象有气泡冒出;装置C中二氧化碳与氢氧化钠反应生成碳酸钠,使装置的质量增加,故装置C增加的质量就是生成二氧化碳的质量;4.4g的二氧化碳中碳元素的质量为![]() =1.2g;本实验还可以通过称量B中玻璃管及其中固体在反应前后的总质量,也能计算出原混合物中碳的质量分数。
=1.2g;本实验还可以通过称量B中玻璃管及其中固体在反应前后的总质量,也能计算出原混合物中碳的质量分数。

 口算题天天练系列答案
口算题天天练系列答案【题目】金属材料和水在生产和生活中有着广泛应用。
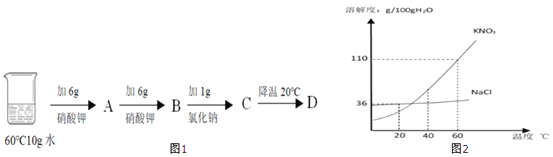
① 水是很好的溶剂。下表是 NaCl 和 KNO3 在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
(g/100g 水) | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
I.两种物质中,溶解度受温度影响变化较大的是______;
II.60℃时,按图示操作

A 中溶液是_______(填“饱和”或“不饱和”)溶液,C 中溶液的总质量是_______g;
III.50℃时,将两种物质的饱和溶液各 100 g,分别加热蒸发 10 g 水后,再恢复到 50℃, 则以下说法正确的是______(选填编号)。
a.有 NaCl 晶体析出,无 KNO3 晶体析出
b.两溶液中溶质与溶剂的质量比都增大
c.剩余溶液的质量:NaCl 溶液大于 KNO3 溶液 d.析出 NaCl 晶体 3.7 g
② 铁制品在潮湿空气中容易生锈,请写出工业上除铁锈的方法_________(用化学方程式表示)。
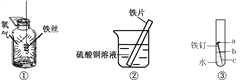
③ 某同学将一定质量的 Zn 粉放入 AgNO3 与 Cu(NO3)2 的混合溶液中,实验流程如图所示:
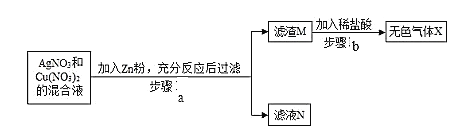
I.步骤 b 中生成的无色气体 X 是_________,滤液 N 中的溶质是_____;
II.步骤 a 中发生反应的化学方程式____(任写一个即可)。