题目内容
【题目】金属材料和水在生产和生活中有着广泛应用。
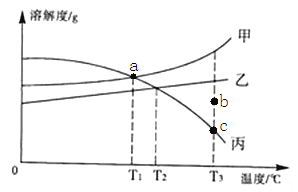
① 水是很好的溶剂。下表是 NaCl 和 KNO3 在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
(g/100g 水) | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
I.两种物质中,溶解度受温度影响变化较大的是______;
II.60℃时,按图示操作

A 中溶液是_______(填“饱和”或“不饱和”)溶液,C 中溶液的总质量是_______g;
III.50℃时,将两种物质的饱和溶液各 100 g,分别加热蒸发 10 g 水后,再恢复到 50℃, 则以下说法正确的是______(选填编号)。
a.有 NaCl 晶体析出,无 KNO3 晶体析出
b.两溶液中溶质与溶剂的质量比都增大
c.剩余溶液的质量:NaCl 溶液大于 KNO3 溶液 d.析出 NaCl 晶体 3.7 g
② 铁制品在潮湿空气中容易生锈,请写出工业上除铁锈的方法_________(用化学方程式表示)。
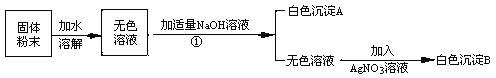
③ 某同学将一定质量的 Zn 粉放入 AgNO3 与 Cu(NO3)2 的混合溶液中,实验流程如图所示:
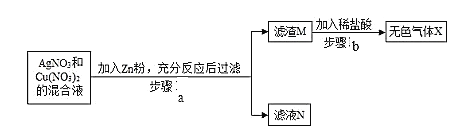
I.步骤 b 中生成的无色气体 X 是_________,滤液 N 中的溶质是_____;
II.步骤 a 中发生反应的化学方程式____(任写一个即可)。
【答案】 KNO3 不饱和 167.6 cd Fe2O3+6HCl=2FeCl3+3H2O H2 Zn(NO3)2 Zn+2AgNO3=2Ag+Zn(NO3)2或 Zn+Cu(NO3)2=Cu+Zn(NO3)2
【解析】① I、分析根据溶解度表可知,两种物质中溶解度受温度影响变化较大的是KNO3;
II、60℃时,KNO3的溶解度是110.0g,即60℃时,100g水中溶解110.0g KNO3达到饱和状态,A中溶液有水100g ,KNO340g,所以A中溶液是不饱和溶液;20℃时,KNO3的溶解度是31.6g,即20℃时,100g水中最多溶解31.6g KNO3,20℃时,NaCl的溶解度是36g,即20℃时,100g水中最多溶解36gNaCl,C 中溶液的总质量=100g+36g+31.6g=167.6g;
III、a、50℃时,将两种物质的饱和溶液各 100 g,分别加热蒸发 10 g 水后,再恢复到 50℃,都有晶体析出,错误; b、50℃时,将两种物质的饱和溶液各 100 g,分别加热蒸发 10 g 水后,再恢复到 50℃,两溶液仍为饱和溶液,两溶液中溶质与溶剂的质量比没有改变,错误; c、由表中的数据可知,在50℃时,KNO3溶解度大于NaCl的溶解度,所以50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,KNO3析出的晶体多,剩余溶液的质量:NaCl溶液大于KNO3溶液,正确; d、设:析出 NaCl 晶体质量为x,则有100g:37g=10g:x,x=3.7g,正确。故选cd;
②工业上除铁锈的方法是用稀盐酸与氧化铁反应生成氯化铁和水,化学方程式是:Fe2O3+6HCl=2FeCl3+3H2O;
③由于金属的活动性是:锌>铜>银,将一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,锌先与硝酸银反应生成了银和硝酸锌,当硝酸银完全反应后,再与硝酸铜反应生成了硝酸锌和铜。由流程图可知,向过滤后的滤渣中加稀硫酸有气泡生成,说明了锌粉是过量的,生成的无色气体应为氢气,溶液中的硝酸银和硝酸铜完全发生了反应,所以:
(1)步骤Ⅱ中生成的无色气体X是氢气,该反应锌与稀硫酸反应生成了硫酸锌和氢气,基本反应类型是置换反应,滤液N中的溶质是硝酸锌;
(2)由上述分析可知,步骤Ⅰ中所发生的反应的化学方程式有:Zn+2AgNO3═Zn(NO3)2+2Ag、Zn+Cu(NO3)2═Zn(NO3)2+Cu。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案