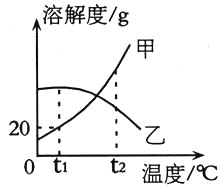
题目内容
【题目】实验室中有一包固体混合物,其中可能含有Cu、CuO、NaOH、Na2CO3、CaCl2、KCl六种物质中的两种或多种。按如图所示进行实验,出现的现象如图所示:
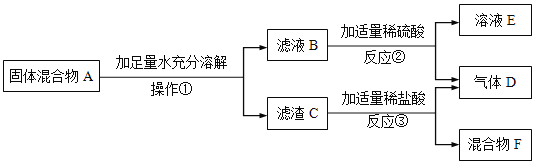
试根据实验过程和发生的现象判断:
(1)操作①的名称是___________,该操作需要的实验仪器有___________。
(2)反应②的化学反应类型是____________。
(3)将滤渣C干燥后在空气中充分灼烧,若灼烧前后固体质量不变,滤渣C中一定含有__________,它们的质量之比为__________;写出反应③可能发生反应的化学方程式______________。
(4)若混合物F为蓝色澄清溶液,再结合其它现象可判断混合物A中一定含______________。
【答案】过滤 铁架台、漏斗、烧杯、玻璃棒 复分解反应 Cu和CaCO3 44:25 CaCO3+2HCl=CaCl2+H2O+CO2↑、CuO+2HCl=CuCl2+H2O CuO、Na2CO3、CaCl2
【解析】
(1)通过操作①得到滤渣和滤液,所以操作①是过滤。该操作需要的实验仪器有铁架台、漏斗、烧杯、玻璃棒。
(2)反应②是滤液B与稀硫酸反应产生气D,则滤液中一定有碳酸钠,生成气D为二氧化碳,该反应是酸与盐的反应,反应类型属于复分解反应。
(3)将滤渣C干燥后在空气中充分灼烧,若灼烧前后固体质量不变,滤渣C中一定含有Cu和CaCO3,铜和氧气灼烧生成氧化铜,反应后固体质量增加,增加的质量为参加反应的氧气的质量。碳酸钙灼烧生成氧化钙和二氧化碳,反应后固体质量减少,减少的质量为二氧化碳气体的质量。灼烧前后固体质量不变,也就是参加反应氧气的质量与生成二氧化碳的质量相等。设参加反应的氧气的质量或生成二氧化碳的质量为M。根据反应方程式![]() ,铜的质量为
,铜的质量为![]() ;根据方程式
;根据方程式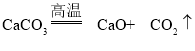 ,碳酸钙的质量为
,碳酸钙的质量为![]() ;铜与碳酸钙的质量比为
;铜与碳酸钙的质量比为![]() :
:![]() =44:25。反应③可能发生的反应是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,氧化铜和盐酸反应生成氯化铜和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,CuO+2HCl=CuCl2+H2O。
=44:25。反应③可能发生的反应是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,氧化铜和盐酸反应生成氯化铜和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,CuO+2HCl=CuCl2+H2O。
(4)若混合物F为蓝色澄清溶液,则混合物A有氧化铜,滤液B与硫酸反应有气体生成,则混合物A有碳酸钠,滤渣C与盐酸反应有气体生成,滤渣C有碳酸钙,则混合物A有氯化钙。所以混合物A中一定含CuO、Na2CO3、CaCl2。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下充分反应后,测得有关数据如下表所示:
物质 | M | N | Q | P |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量 /g | 0 | 12 | 15 | 待测 |
已知M的相对分子质量为n,P的相对分子质量为2n,下列推理正确的是 。
A.反应后生成Q的质量为15g
B.反应中N与P发生改变的质量之比为1∶1
C.反应后P的质量为12g
D.该反应化学方程式中M与P的化学计量数之比为2∶3