题目内容
【题目】下图是实验式制取气体的常用装置。

(1)写出个选用A或B装置制取氧气化学方程式____________。
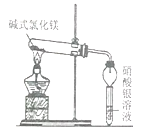
(2)若采用C收集氧气,气体由_______(填a或b)口进入,如何检验该气体?________
【答案】 2KMnO4![]() K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3 ![]() 2KCl+3O2↑或2H2O2
2KCl+3O2↑或2H2O2![]() 2H2O+O2↑ a 将带火星的木条伸入集气瓶中,若木条复燃,则为氧气。
2H2O+O2↑ a 将带火星的木条伸入集气瓶中,若木条复燃,则为氧气。
【解析】(1)制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热;化学方程式为:2KMnO4 ![]() K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3 ![]() 2KCl+3O2↑或2H2O2
2KCl+3O2↑或2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)氧气密度比空气大,可以采用向上排空气法收集,所以气体应该由a口进入;将带火星的木条伸入集气瓶中,若木条复燃,则为氧气。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】甲烷在一定量的氧气中燃烧.测得反应前后各物质的质量如下:
物质 | 甲烷 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 4.4 | 待测 |
下列判断不正确的是
A. X不是该反应的催化剂 B. 反应后X的质量为2.8g
C. X中两种元素的质量比为1:2 D. 反应中甲烷与氧气的化学计量数之比为4:7
【题目】为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下:
试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
所取样品的质量/g | 50.0 | 50.0 | 50.0 | 50.0[ |
加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
请回答下列问题并计算:
(1)经分析,在第1次实验结束后,反应物_________完全反应完了。
(2)50.0g样品与足量稀硫酸反应最多能生成气体_________g。
(3)计算样品中锌的质量分数(写出具体计算过程)。

(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。