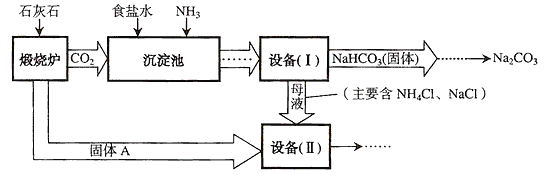
题目内容
【题目】下图是化学兴趣小组成员用一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁的装置。
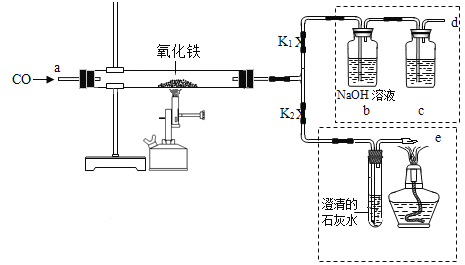
(1)关闭K1,开启K2.可以验证CO还原Fe2O3的产物,请写出硬质玻璃管中发生反应的化学方程式__________________。
(2)①关闭K2.开启K1,可以将d口出来的纯净干燥气体再重新通入装置而循环使用,b瓶溶液的作用是_______,c瓶中应装__________,
②d连接a的目的是__________________。
【答案】 3CO+Fe2O3![]() 2Fe+3CO2 除去反应中生成的一氧化碳 浓硫酸 防止氧化碳排放到空气中或让没反应了的CO循环使用
2Fe+3CO2 除去反应中生成的一氧化碳 浓硫酸 防止氧化碳排放到空气中或让没反应了的CO循环使用
【解析】(1)一氧化碳能与氧化铁在高温下反应生成铁和二氧化碳,CO还原Fe2O3的化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(2)①尾气中的二氧化碳能与氢氧化钠溶液反应,所以b中的氢氧化钠溶液是除去反应中生成的二氧化碳;c中盛放浓硫酸,对气体起到了干燥的作用;
②d连接a能防止一氧化碳排放到空气中,防止污染空气,过量的CO排出后进入a循环利用,可以减少碳的排放,提高原料利用率。

【题目】为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下:
试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
所取样品的质量/g | 50.0 | 50.0 | 50.0 | 50.0[ |
加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
请回答下列问题并计算:
(1)经分析,在第1次实验结束后,反应物_________完全反应完了。
(2)50.0g样品与足量稀硫酸反应最多能生成气体_________g。
(3)计算样品中锌的质量分数(写出具体计算过程)。

(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系。