题目内容
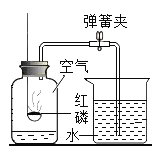
【题目】甲同学在做Fe与H2SO4溶液反应实验时,发现生成的气体有刺激性气味,于是进行了探究。
(提出问题) Fe与H2SO4溶液反应生成的气体为什么有刺激性气味?
(查阅资料)(1)6H2SO4(浓)+2Fe= Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去.SO2与二氧化碳相似,能与氢氧化钠反应.
(3)点燃充满氢气的小试管,会有轻微的爆鸣声.
(进行猜想)Fe与不同浓度的H2SO4 溶液反应,生成的气体产物中可能有SO2。
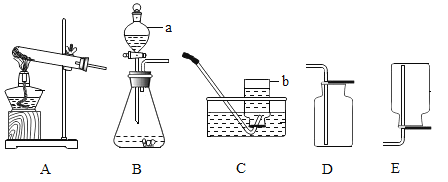
(实验探究)甲同学用图甲所示的装置进行实验,并将E 中收集到的气体进行如图乙所示的爆鸣实验。
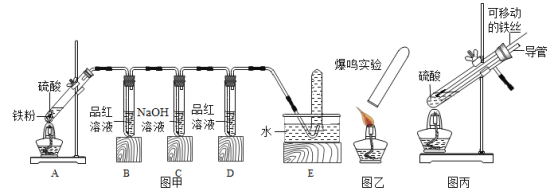
请帮他完成下表:
A中硫酸浓度 | 实验现象 | A中生成气体成分 | |||
B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
实验一 | 98% | ①_ | 不褪色 | 无爆鸣声 | 只有SO2 |
实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | ②_ |
实验三 | 25% | ③__ | 不褪色 | ④_ | 只有H2 |
(实验结论)铁与不同浓度的H2SO4反应,生成的气体产物可能不同,当H2SO4溶液浓度达到足够大时,生成的气体产物中有SO2。
(交流反思)写出实验三中Fe与H2SO4溶液反应的化学方程式___,写出实验二中发生爆鸣反应的化学方程式_____。实验一中C装置的作用是__。
(拓展延伸)甲同学又将A装置进行了如图丙所示的改进(图丙中试管上的支管接B装置),试增加的导管下端伸入液面以下的原因____。
【答案】品红溶液褪色 含有二氧化硫和氢气 品红溶液不褪色 有爆鸣声 Fe+H2SO4═FeSO4+H2↑ 2H2+O2![]() 2H2O 吸收二氧化硫 形成液封,防止生成的气体逸出
2H2O 吸收二氧化硫 形成液封,防止生成的气体逸出
【解析】
二氧化硫可以使品红溶液褪色,B中品红溶液可以检验是否有二氧化硫气体生成,C中氢氧化钠可以吸收二氧化硫气体,D中品红溶液的作用是验证二氧化硫是否吸收完全,E装置是排水收集氢气的装置,不纯的氢气燃烧会有爆鸣声。
[实验探究]
实验过程如下所示:
A中硫 | 实验现象 | A中生成气体成分 | |||
B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
实验一 | 98% | 品红溶液褪色 | 不褪色 | 无爆鸣声 | 只有SO2 |
实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | 含有二氧化硫和氢气 |
实验三 | 25% | 品红溶液不褪色 | 不褪色 | 有爆鸣声 | 只有H2 |
故填:品红溶液褪色;含有二氧化硫和氢气;品红溶液不褪色;有爆鸣声;
[交流反思]
实验三中铁与硫酸溶液反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑;实验二中发生爆鸣反应的化学方程式为:2H2+O2![]() 2H2O;实验一中C装置的作用是吸收二氧化硫。故填:Fe+H2SO4═FeSO4+H2↑;2H2+O2
2H2O;实验一中C装置的作用是吸收二氧化硫。故填:Fe+H2SO4═FeSO4+H2↑;2H2+O2![]() 2H2O;吸收二氧化硫;
2H2O;吸收二氧化硫;
[拓展延伸]
增加的导管下端伸入液面以下原因是形成液封,防止生成的气体逸出;故填:形成液封,防止生成的气体逸出。

【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
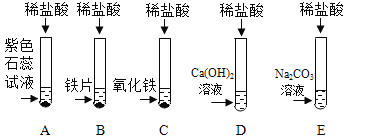
(1)C 试管中所发生反应的化学方程式为 ____________ 。
(2)将反应后 D、E 试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯 中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。 (提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想一:NaCl。
猜想二:NaCl 和 CaCl2。
猜想三:__________________。
猜想四:NaCl、Ca(OH)2和 HCl 。
老师指出猜想四是错误的,原因是_______________。 (设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
甲取少量滤液于试管中,滴加适量的碳酸钠溶液 | _____________ | 猜想二不成立 |
乙取少量滤液于试管中,滴加__________(填名称) | 出现气泡 | 猜想三成立 |