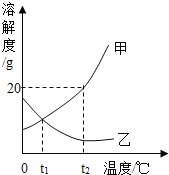
题目内容
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
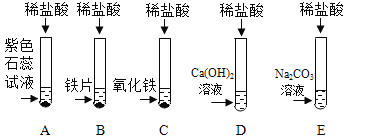
(1)C 试管中所发生反应的化学方程式为 ____________ 。
(2)将反应后 D、E 试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯 中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。 (提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想一:NaCl。
猜想二:NaCl 和 CaCl2。
猜想三:__________________。
猜想四:NaCl、Ca(OH)2和 HCl 。
老师指出猜想四是错误的,原因是_______________。 (设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
甲取少量滤液于试管中,滴加适量的碳酸钠溶液 | _____________ | 猜想二不成立 |
乙取少量滤液于试管中,滴加__________(填名称) | 出现气泡 | 猜想三成立 |
【答案】Fe2O3+6HCl=2FeCl3+3H2O NaCl和Na2CO3 氢氧化钙与盐酸不共存 无白色沉淀生成 稀盐酸
【解析】
(1)C 试管中氧化铁会与稀盐酸反应生成氯化铁和水,此反应的化学方程式为 :Fe2O3+6HCl=2FeCl3+3H2O。
(2)在D中盐酸与氢氧化钙反应生成氯化钙和水,在E中盐酸与碳酸钠生成氯化钠和水和二氧化碳。将D与E反应后的废液混合先有气泡产生,说明D中盐酸过量,E中碳酸钠过量,后有白色沉淀,说明碳酸钠过量较多,最终溶液等同于氯化钙与碳酸钠反应后溶液的成分中加了氯化钠,所以最后的溶液中溶质成分可能是:只有氯化钠;可能是:氯化钠和过量的氯化钙,也可能是:氯化钠与过量的碳酸钠。所以猜想三是:NaCl和Na2CO3。
猜想四是错误的,原因是氢氧化钙与盐酸不共存。
甲取少量滤液于试管中,滴加适量的碳酸钠溶液,因为结论是猜想二不成立,所以实验的现象应是无白色沉淀生成,因为猜想二不成立,说明溶液中无氯化钙,如有氯化钙,则滴入碳酸钠后会生成白色沉淀,故不成立,则无白色沉淀生成。
乙取少量滤液于试管中,滴加稀盐酸,出现气泡,猜想三成立。因为碳酸钠会与稀盐酸反应生成二氧化碳气体,所以现象中才会有气泡产生。
故填:(1)Fe2O3+6HCl=2FeCl3+3H2O
(2)NaCl和Na2CO3 氢氧化钙与盐酸不共存
无白色沉淀生成
稀盐酸。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】甲同学在做Fe与H2SO4溶液反应实验时,发现生成的气体有刺激性气味,于是进行了探究。
(提出问题) Fe与H2SO4溶液反应生成的气体为什么有刺激性气味?
(查阅资料)(1)6H2SO4(浓)+2Fe= Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去.SO2与二氧化碳相似,能与氢氧化钠反应.
(3)点燃充满氢气的小试管,会有轻微的爆鸣声.
(进行猜想)Fe与不同浓度的H2SO4 溶液反应,生成的气体产物中可能有SO2。
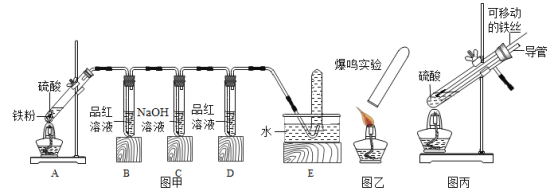
(实验探究)甲同学用图甲所示的装置进行实验,并将E 中收集到的气体进行如图乙所示的爆鸣实验。
请帮他完成下表:
A中硫酸浓度 | 实验现象 | A中生成气体成分 | |||
B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
实验一 | 98% | ①_ | 不褪色 | 无爆鸣声 | 只有SO2 |
实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | ②_ |
实验三 | 25% | ③__ | 不褪色 | ④_ | 只有H2 |
(实验结论)铁与不同浓度的H2SO4反应,生成的气体产物可能不同,当H2SO4溶液浓度达到足够大时,生成的气体产物中有SO2。
(交流反思)写出实验三中Fe与H2SO4溶液反应的化学方程式___,写出实验二中发生爆鸣反应的化学方程式_____。实验一中C装置的作用是__。
(拓展延伸)甲同学又将A装置进行了如图丙所示的改进(图丙中试管上的支管接B装置),试增加的导管下端伸入液面以下的原因____。