题目内容
【题目】将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:

(1)图二从A到B过程中,溶液的pH逐渐________(填“增大”或“减小”)。
(2)图二表示酸碱恰好完全反应的点是________。
(3)计算稀盐酸中溶质的质量分数________。
【答案】 减小 B 3.65%
【解析】(1)根据溶液pH的变化分析解答;
(2)根据中和反应是放热反应分析解答;
(3)根据氢氧化钠的质量分数计算稀盐酸中溶质的质量分数。
解:(1)图二从A到B过程中,溶液的pH逐渐减小;
(2) 中和反应是放热反应,当酸碱恰好完全反应时放出的热量最多,溶液的温度最高,所以图二表示酸碱恰好完全反应的点是B;
(3)由图像可知,酸碱恰好中和时消耗稀盐酸的质量是20g。
设20 g稀盐酸中溶质的质量为x。
NaOH+HCl=NaCl+H2O
40 36.5
20 g×4% x
![]()
x=0.73 g
稀盐酸中溶质的质量分数为![]() ×100%=3.65%
×100%=3.65%
答:稀盐酸中溶质的质量分数为3.65%。

【题目】初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH﹣═H2O。如图,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。
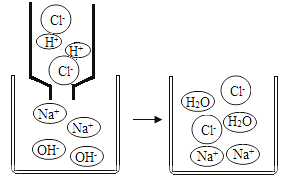
离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)
①写出Na2SO4与BaCl2反应的化学方程式: 。
②把易溶于水、易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:2Na++SO42﹣+Ba2++2Cl﹣═BaSO4↓+2Na++2Cl﹣。
③删去方程式两边不参加反应的离子:Ba2++SO42﹣═BaSO4↓。
④检查方程式两边各元素的原子个数和电荷总数是否相等。
请回答:
(1)下列各组中的离子,在pH=3的水溶液中能大量共存的是 。
A.Na+、Mg2+、Cl﹣、SO4 2﹣ | B.Na+、K+、Cl﹣、OH﹣ |
C.Na+、Cu2+、Cl﹣、SO42﹣ | D.Na+、K+、Cl﹣、CO32﹣ |
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式 。
(3)写出一个与离子方程式Mg+2H+═Mg2++H2↑相对应的化学方程式 。
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或 生成,反应就能发生。
【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】
1.草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O43H2O![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
2.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
3.铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间学进行如下实验。(装置气密性良好)

(1) 该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是 (填字母序号)
A.浓硫酸 B.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 。
(3)写出E装置中所发生反应的一个化学方程式: 。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 。
【实验反思】
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 (选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 。
