题目内容
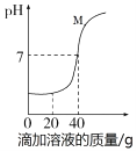
【题目】有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5 g样品加入100 g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如下图所示。试求:

(1)样品中金属铜的质量是 g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
【答案】(1)19.5;(2)19.6%
【解析】根据反应的化学方程式解答。
解:(1)由图可知,生成氢气的质量为0.4g。
设样品中锌的质量为x,消耗硫酸的质量为y。
Zn+ H2SO4 == ZnSO4 + H2↑
65 98 2
x y 0.4g
![]()
x=13g
y=19.6g
因此样品中铜的质量为32.5g-13g=19.5g
(2)所用稀硫酸的溶质质量分数![]() =19.6%。
=19.6%。
答:所用稀硫酸的溶质质量分数为19.6%。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
【题目】下列广告词对应商品的主要成分及类别不正确的是
选项 | 广告词 | 商品 | 主要成分 | 类别 |
A. | “衡水老白干,喝出男人味” | 白酒 | 乙醇 | 有机物 |
B. | “特别的味,给特别的您” | 凤利酥 | 淀粉 | 蛋白质 |
C. | “补钙新一代,骨康都期待” | 补钙剂 | 碳酸钙 | 盐 |
D. | “农夫山泉有点甜” | 矿泉水 | 水 | 化合物 |
A. A B. B C. C D. D