题目内容
【题目】如图是a、b、c三种固体物质在水中的溶解度曲线,请回答下列问题:
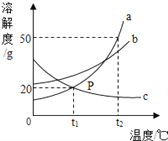
(1)t1℃时a物质的溶解度是____g,该温度下a物质的饱和溶液中溶质的质量分数为___。
(2)将c物质从其溶液中分离出来的常用方法是__。
(3)将t2℃时a、b、c三种物质饱和溶液降温到t1℃后(降温过程中溶剂的质量不变),三种溶液中溶质的质量分数由大到小的顺序是______(填字母)。
【答案】 20 16.7% (蒸发)结晶 b>a>c
【解析】由题中信息知,(1)t1℃时a物质的溶解度是20g, 该温度下a物质的饱和溶液中溶质的质量分数为![]() ×100%=16.7% 。(2)将c物质从其溶液中分离出来的常用方法是(蒸发)结晶。 (3)将t2℃时a、b、c三种物质饱和溶液降温到t1℃后(降温过程中溶剂的质量不变),三种溶液中溶质的质量分数由大到小的顺序是b>a>c。
×100%=16.7% 。(2)将c物质从其溶液中分离出来的常用方法是(蒸发)结晶。 (3)将t2℃时a、b、c三种物质饱和溶液降温到t1℃后(降温过程中溶剂的质量不变),三种溶液中溶质的质量分数由大到小的顺序是b>a>c。
点睛∶本题主要考查溶解度曲线的含义。

练习册系列答案
相关题目