题目内容
【题目】过氧化钙晶体(CaO2xH2O)是优良的供氧剂,受热会逐渐失水,120℃时完全分解为CaO2,350℃时CaO2迅速分解为CaO和O2。
(一)【性质探究】取少量CaO2于试管中加过量稀盐酸,无气泡产生;再加少量MnO2粉末,产生大量气泡。静置、取上层清液,逐渐加入碳酸钠溶液,先产生大量气泡,再出现白色沉淀。
(1)CaO2和盐酸发生复分解反应的化学方程式为____________________________。
(2)加入碳酸钠溶液,产生的气体是______;出现白色沉淀,说明上层清液中含________。
(二)【制备流程】
方法1:由Ca(OH)2为原料制备CaO28H2O流程如下:

陈化:让初生晶体和母液放置一段时间,使晶体由小长大。
(1)将反应2及陈化的化学方程式补充完整:
CaCl2+H2O2+2NH3H2O+6_____=CaO28H2O↓+2NH4Cl。
(2)检验固体是否洗净的方法是:___________________________________。
(3)制备过程中除水外可循环使用的物质是:___________(填化学式)。
方法2:由鸡蛋壳(含较多CaCO3)为原料制备CaO28H2O流程如下:

(4)反应器中由化合反应生成CaO2·8H2O,反应化学方程式为:_________________。
(5)在反应器中,应__________。
①先加水冷却后再加双氧水 ②先加双氧水冷却后再加水
(6)若煅烧充分,则获得的CaO28H2O中还含有的固体杂质是_______(填化学式)。
(7)“绿色化学”是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是_________(填“方法1”或“方法2”)。
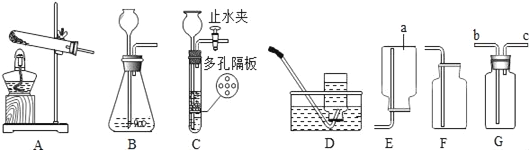
(三)【组成测定】若所得产品为CaO2·xH2O,下列装置可测定该产品的组成(样品中的杂质受热不反应)。

(1)实验前先缓慢通N2一段时间,控温将样品加热到350℃至CaO2分解完全;继续缓慢通N2,其目的是_________________________________(答一点即可)。
(2)装置B作用是________________(填序号)
①测定产生的H2O质量 ②便于观察和控制气流速度
(3)若2.7g样品,加热到350℃至CaO2分解完全,测得B装置重1.44g、C中铜网增重0.16g。
则x=________。
【反思】若先加热A,后加热C装置,测得X值______(填“偏大”、“偏小”或“不变”)。
【答案】 CaO2+2HCl==CaCl2+H2O2 CO2 CaCl2 H2O 取最后一次洗涤后的滤液,滴入AgNO3溶液,无现象 NH4Cl CaO+H2O2+7H2O=CaO28H2O ① Ca(OH)2 方法2 使生成的气体被完全吸收或防止倒吸(合理的答案均给分) ①② 8 偏大
【解析】(一)【性质探究】(1)取少量CaO2于试管中加过量稀盐酸,无气泡产生;再加少量MnO2粉末,产生大量气泡,说明反应中生成了H2O2,则CaO2和盐酸发生复分解反应的化学方程式为CaO2+2HCl==CaCl2+H2O2;
(2)盐酸过量,加入碳酸钠溶液与之反应生成CO2气体;混合液中有CaCl2 ,滴加碳酸钠溶液生成白色沉淀CaCO3;
(二)【制备流程】
(1)化学反应过程遵守原子守恒,则反应CaCl2+H2O2+2NH3H2O+6_____=CaO28H2O↓+2NH4Cl中未知反应物为H2O;
(2)固体表面附着液中含有NH4Cl,则取最后一次洗涤后的滤液,滴入AgNO3溶液,无现象,可知固体洗净;
(3)由图示可知,过滤获得CaO28H2O固体后的滤液中含有NH4Cl,可循环利用;
方法2:(4)氧化钙与水反应生成氢氧化钙,氢氧化钙和双氧水反应生成过氧化钙晶体,化学方程式为:CaO+H2O2+7H2O=CaO28H2O;
(5)温度过高过氧化物会分解生成氧化物和氧气,则在反应器中,应先加水冷却后再加双氧水,答案为①;
(6)若煅烧充分,过量的CaO与水反应生成氢氧化钙,即获得的CaO28H2O中还含有的固体杂质是Ca(OH)2 ;
(7)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,方法2中没有副产物,方法1中有副产物二氧化碳,所以上述两种方法中生成CaO28H2O的反应符合“绿色化学”的是:方法2;
(三)【组成测定】
(1)实验前先缓慢通N2一段时间,除去空气中的氧气,反应结束后继续缓慢通N2,其目的是使生成的气体被完全吸收,同时防止倒吸;
(2)装置B是利用浓硫酸吸收生成的水,同时根据气泡数量,便于观察和控制气流速度,故答案为①和②;
(3)若2.7g样品,加热到350℃至CaO2分解完全,测得B装置重1.44g、C中铜网增重0.16g。
2CaO2·xH2O![]() 2CaO+2xH2O+O2↑
2CaO+2xH2O+O2↑
36x 32
1.44g 0.16
![]() =
=![]() ,解得:x=8;
,解得:x=8;
【反思】若先加热A,后加热C装置,则有部分氧气不能被灼热的Cu反应,导致氧气质量偏低,测得X值偏大。