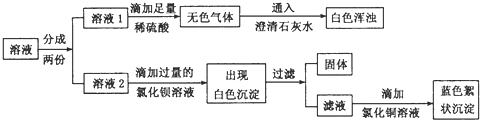
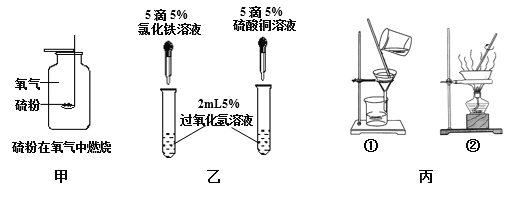
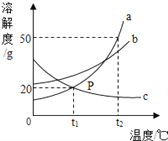
题目内容
【题目】某炼铁厂对本厂购进的赤铁矿样品(主要成分是氧化铁)进行分析。取20g样品放入烧杯中,加入219g稀盐酸时恰好完全反应,过滤后所得溶液的质量为235g
(假设杂质既不溶于酸,也不溶于水;不考虑实验中溶液的质量损失)。
请计算:
(1)赤铁矿样品中铁元素的质量分数为 %。
(2)所用稀盐酸中溶质的质量分数。(结果精确到1%)
【答案】(1)56%;(2)10%
【解析】(1)由质量守恒定律知,赤铁矿样品中含氧化铁质量为20g-﹙20g+219g-235g﹚=16g. 赤铁矿样品中铁元素的质量分数为∶16g×![]() ×100%=11.2g.
×100%=11.2g.
![]() ×100%=56%;
×100%=56%;
(2)解∶设所用稀盐酸中溶质的质量为xg
Fe2O3 +6HCl=2FeCl3 +3H2O
160 219
16g x
![]() =
=![]() ,x=21.9g. 所用稀盐酸中溶质的质量分数∶
,x=21.9g. 所用稀盐酸中溶质的质量分数∶![]() ×100%=10%.
×100%=10%.
答∶(1)赤铁矿样品中铁元素的质量分数为56%;
(2)所用稀盐酸中溶质的质量分数是10%。
点睛∶本题主要考查质量守恒定律的应用以及根据化学方程式进行计算。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目