题目内容
【题目】2.3g某物质在空气中完全燃烧生成4.4g二氧化碳和2.7g水,则关于这种物质的组成描述正确的是(____)
A.该物质只含有碳元素和氢元素
B.该物质一定含有碳元素和氢元素,可能含有氧元素
C.该物质中碳元素与氢元素的质量比为12︰3
D._______________________________________
【答案】C 该物质中有碳氢氧三种元素
【解析】
A、4.4g二氧化碳中碳元素的质量为:4.4g×![]() =1.2g,2.7g的水中含有氢元素的质量为:2.7g×
=1.2g,2.7g的水中含有氢元素的质量为:2.7g×![]() =0.3g,碳、氢元素的质量和为:1.2g+0.3g=1.5g,物质的质量是2.3g,故物质中碳、氢、氧三种元素,故A错误;
=0.3g,碳、氢元素的质量和为:1.2g+0.3g=1.5g,物质的质量是2.3g,故物质中碳、氢、氧三种元素,故A错误;
B、由A分析可知,B错误;
C、该物质中碳、氢元素的质量比为1.2:0.3=12:3,故正确。故选C。
由以上分析可知,该物质中含有碳、氢、氧三种元素。

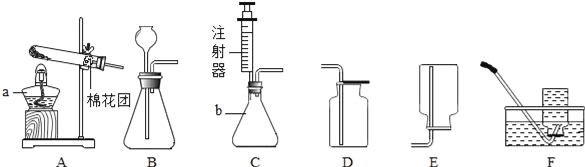
【题目】小丽对家中的家用制氧机产生了浓厚的兴趣.她通过阅读说明书了解到家用制氧机的工作原理如下:加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气.减压时,分子筛将所吸附的氮气排放.整个过程中,分子筛并不消耗.小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究.
实验![]() :小丽欲通过以下实验验证所收集的气体是否为纯净的氧气.
:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气.
(实验记录)
实验步骤 | 实验现象 | 化学方程式 |
取一只 | 木炭燃烧得更旺 | 化学方程式 |
表中,化学方程式![]() 是________.
是________.
(实验结论)收集的气体是纯净的氧气.
(实验反思)老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气.该实验不能证明所收集气体为纯净氧气的原因是________.
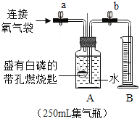
实验![]() :测定小丽所带气体中氧气的含量.
:测定小丽所带气体中氧气的含量.
同学们在老师的指导下设计了如图所示装置,进行实验,并重复多次.
(实验记录)
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性 | / | 装置的气密性良好 |
② | 加入药品,将装置连接固定 | / | / |
③ | 打开止水夹 | p> | 收集 |
④ | 用凸透镜聚光引燃白磷 | 燃烧,产生大量白烟 | / |
⑤ | 待白磷熄灭并冷却到室温, 进行操作 | 现象 | 小丽收集的气体不是纯净的氧气 |
表中,操作![]() 是________;现象
是________;现象![]() 是________.
是________.
(数据记录)
实验次序 |
|
|
|
|
|
|
|
|
|
|
|
(数据处理)已知,在上表数据中,第![]() 组数据偏差较大,存在明显误差,在数据处理时应删去.小丽所带气体中氧气的体积分数为________
组数据偏差较大,存在明显误差,在数据处理时应删去.小丽所带气体中氧气的体积分数为________![]() .
.
(实验反思)
(1)这台家用制氧机制氧气的过程发生的变化属于________(填“物理变化”或“化学变化”).
(2)导致第![]() 组数据产生较大误差的可能原因是________.
组数据产生较大误差的可能原因是________.
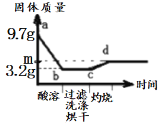
【题目】某实验小组的同学用氯化钙粉末、碳酸钠粉末、粒状大理石、稀盐酸、稀硫酸这几种药品,探究哪两种药品适合在实验室制取CO2。
请你参与下列的探究并回答问题。
(资料卡片)硫酸钙微溶于水,易在碳酸钙表面形成一层隔膜。
(提出问题)上述的酸和碳酸盐的反应是否适合在实验室制取CO2?
(方案设计)小红认为可选用稀硫酸、氯化钙反应制得CO2,小江认为不可能,小江的理由是_________。
大家经过讨论后,设计了如下三个实验进行对比分析。
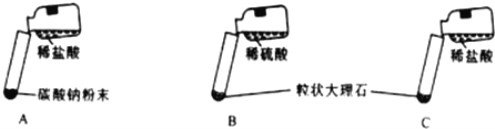
(实验与结论)(1)请你填写实验报告中①、②处的内容。
实验 | 实验现象 | 实验分析、结论 |
A | 剧烈反应,急速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取二氧化碳 |
B | 产生气泡,速率迅速减慢,随后反应几乎停止 | 无法持续产生CO2,不能用于实验室制取CO2 |
C | 现象:_________ | 反应速率适中,气体便于收集 |
(2)根据探究结论,适合在实验室制取二氧化碳的是_______ (从A、B、C中选一种)。
(3)实验室不能用实验B制取二氧化碳的原因是______。
(拓展与迁移)(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等。请你再写出一种需要考虑的因素:_____ ,C+O2![]() CO2 是我们最熟悉的反应,生成物也只有CO2,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是_________。(答出1条)
CO2 是我们最熟悉的反应,生成物也只有CO2,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是_________。(答出1条)
(2)以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 |
| 2 | 49.21 |
④ | 30 | 5 | 55 |
| 2 | 10.76 |
通过实验①和②对比可知,化学反应速率与_____有关;
从实验③和④对比可知,化学反应速率与温度的关系是:_________。
(3)某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
①哪几项反应中盐酸有剩余_____________;
②上表中m的数值是__________________;
③试计算这种石灰石矿中碳酸钙的质量分数_________。(要有完整的计算过程)